Зависимость скорости реакции от температуры. правило Вант-Гоффа. Понятие об активных частицах и энергии активации. Уравнение Аррениуса.Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа: активные частиц ы – молекулы которые обладают энергией, что бы разорвать или ослабить связи в исходных частицах, и тем самым создать новые молекулы. энергия активации – некоторая избыточная энергия, которой должны обладать молекулы для того что бы их столкновение привело к образованию нового вещества. Уравне́ние Арре́ниуса устанавливает зависимость константы скорости %A%D%B%D%BC%D%B%D%87%D%B%D%81%D%BA%D%B%D%B_%D%80%D%B%D%B%D%BA%D%86%D%B%D%B "химической реакции k=ZPe ^ (-Ea/RT) Z-чисто столкновений молекул. e=2,718…, P-стерический множитель Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия. Особенность гетерогенных равновесий. Смешение истинного химического равновесия. Принцип Ле Шателье и примеры его применения. Обратимые реакции — %A%D%B%D%BC%D%B%D%87%D%B%D%81%D%BA%D%B%D%B_%D%80%D%B%D%B%D%BA%D%86%D%B%D%B "химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:3H2 + N2 ⇌ 2NH3. Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение %92%D%B%D%80%D%B%D%B%D%87%D%B%D%82%D%B%D%B_%D%B%D%B%D%89%D%B%D%81%D%82%D%B%D%B "взрывчатых веществ, %93%D%BE%D%80%D%B%D%BD%D%B%D%B "горение %A%D%B%D%BB%D%B%D%B%D%BE%D%B%D%BE%D%80%D%BE%D%B%D% B"углеводородов, образование %AD%D%BB%D%B%D%BA%D%82%D%80%D%BE%D%BB%D%B%D%82%D%B%D%87%D%B%D%81%D%BA%D%B%D%F_%D%B%D%B%D%81%D%81%D%BE%D%86%D%B%D%B%D%86%D%B%D% F"малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓ NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑ Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить %A%D%B%D%BC%D%B%D%87%D%B%D%81%D%BA%D%BE%D%B_%D%80%D%B%D%B%D%BD%D%BE%D%B%D%B%D%81%D%B%D%B "равновесие любой реакции. Химическое равновесие — состояние %A%D%B%D%BC%D%B%D% F"химической системы, в котором F"обратимо протекает одна или несколько %A%D%B%D%BC%D%B%D%87%D%B%D%81%D%BA%D%B%D%F_%D%80%D%B%D%B%D%BA%D%86%D%B%D% F"химических реакций, причём %A%D%BA%D%BE%D%80%D%BE%D%81%D%82%D%C_%D%80%D%B%D%B%D%BA%D%86%D%B%D%B "скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, %D %81%D%82%D%B%D%BE%D%80%D%BE%D%B "концентрации %A%D%B%D%B%D%B%D%B%D%BD%D %82"реагентов, %A%D%B%D%BC%D%BF%D%B%D%80%D%B%D %82%D%83%D %80%D%B "температура и другие параметры системы не изменяются со временем. " А2 + В2 ⇄ 2AB В состоянии равновесия скорости прямой и обратной реакции становятся равными. Конста́нта равнове́сия — величина, определяющая для данной %A%D%B%D%BC%D%B%D%87%D%B%D%81%D%BA%D%B%D%F_%D%80%D%B%D%B%D%BA%D%86%D%B%D% F"химической реакции соотношение между термодинамическими %90%D%BA%D%82%D%B%D%B%D%BD%D%BE%D%81%D%82%D%C_(%D%85%D%B%D%BC%D%B%D% F)"активностями (либо, в зависимости от условий протекания реакции, "парциальными давлениями, %A%D%BE%D%BD%D%86%D%B%D%BD%D%82%D%80%D%B%D%86%D%B%D%F_%D%80%D%B%D%81%D%82%D%B%D%BE%D%80%D%BE%D%B "концентрациями или %A%D%83%D%B%D%B%D%82%D%B%D%B%D%BD%D%BE%D%81%D%82%D%C&action=edit&redlink= "фугитивностями) исходных веществ и продуктов в состоянии "химического равновесия (в соответствии с%81"законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. k=ZPe ^ (-Ea/RT) Выражение const гетерогенного равновесия отсутствуют активные массы, конденсированные (жидких, твёрдых) физ. постоянного состава. Процесс перехода от одного равновесного состояния к новому равновесия назыв. смещение хим. равновесия. Принцип Ле Шателье: Если на систему находящуюся в состояния хим. равновесия. оказать какое-либо воздействие, то равновесия сместится в таком направлении, что оказанное воздействие будет ослаблено. Приведем пример реакции в газовой фазе: 2 NO2 (г) бурый бесцв газ + 57 кДж FeCl3+KSCN Fe(SKN)Cl2+HCl (Интенсивный цвет)
|

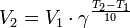
 от %A%D%B%D%BC%D%BF%D%B%D%80%D%B%D%82%D%83%D%80%D%B "температуры
от %A%D%B%D%BC%D%BF%D%B%D%80%D%B%D%82%D%83%D%80%D%B "температуры  .
. N2O4 (г)
N2O4 (г)


