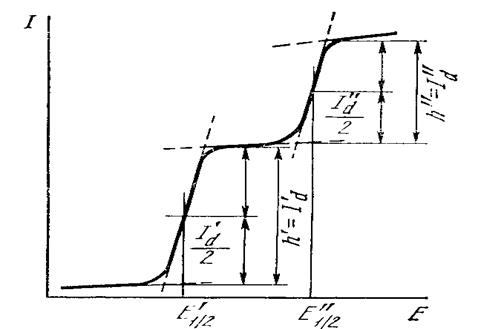
Ниже приведена краткая информация об электроаналитических методах. О том, какие методы применяются в мониторинге ОС и для чего, анализируйте сами!!!Электроаналитические методы Электроаналитические (электрохимические) методы широко используются в анализе вод, атмосферы, почв, пищи [Петрунин, 1987; Алесковский, 1988; Кальвода и др., 1990]. Электроаналитические методыоснованы на использовании электрохимических процессов, происходящих в электролитической ячейке (гальваническом элементе, цепи). Электролитическая ячейка представляет собой электрохимическую систему, состоящую из электродов и электролитов, контактирующих между собой. На границе раздела фаз может происходить электродная реакция между компонентами этих фаз, в результате которой электрический заряд переходит из одной фазы в другую, и на межфазной границе устанавливается потенциал. В отсутствие электрического тока (I = 0) в замкнутой гальванической цепи на межфазной границе устанавливается равновесие и потенциал достигает равновесного значения. Если через ячейку проходит электрический ток (I # 0), на межфазной границе равновесие не достигается и в результате электродного процесса электроны переходят из электрода в раствор (или положительный заряд в обратном направлении). В состав электролитической ячейки входят два или три электрода, один из которых – индикаторный или рабочий, второй – электрод сравнения и третий – вспомогательный. Электрод, действующий как датчик, реагируя на фактор возбуждения и на состав раствора (не оказывая влияния на состав раствора во время измерения), является индикаторным. Если под действием тока, протекающего через ячейку, происходит значительное изменение состава раствора, электрод – рабочий. Электрод сравнения служит для создания измерительной цепи и поддержания постоянного значения потенциала индикаторного (рабочего) электрода. Используемый в трехэлектродной ячейке вспомогательный электрод (противоэлектрод) вместе с рабочим электродом включен в цепь, через которую проходит электрический ток. Электрохимические методы анализа основаны на использовании зависимости электрических параметров от концентрации, природы и структуры вещества, участвующего в электродной (электрохимической) реакции или в электрохимическом процессе переноса зарядов между электродами. Электрохимические методы анализа можно классифицировать следующим образом: 1) методы без протекания электродной реакции, в которых строение двойного электрического слоя в расчет не принимается (кондуктометрия при низких и высоких частотах); 2) методы, основанные на электродных реакциях в отсутствие тока (потенциометрия) или под током (вольтамперометрия, кулонометрия, электрогравиметрия). Электрохимические методы анализа позволяют определять концентрацию вещества в широком интервале (1-10-9 моль/л) с достаточной точностью и воспроизводимостью. Вольтамперометрический метод анализа основан на использовании явления поляризации микроэлектрода, получении и интерпретации вольтамперных (поляризационных) кривых, отражающих зависимость силы тока (I) от приложенного напряжения (Е). В вольтамперометрии используют два электрода: рабочий поляризуемый с малой поверхностью и неполяризуемый электрод сравнения. Если в качестве рабочего выбран электрод с постоянно обновляющейся поверхностью (например, ртутный капающий электрод), то метод называют полярографическим. Если в растворе присутствуют вещества, способные электрохимически восстанавливаться или окисляться, то при наложении на ячейку линейно изменяющегося напряжения (со скоростью, не превышающей 200 мВ/мин) кривая При низких значениях потенциала через ячейку проходит очень незначительный остаточный ток, обусловленный прежде всего током заряжения двойного электрического слоя и присутствием в растворе электрохимически более активных, чем анализируемое вещество, примесей. При увеличении потенциала электрохимически активное вещество (называемое деполяризатором) вступает в электрохимическую реакцию на электроде и ток в результате этого резко возрастает. Это так называемый фарадеевский ток (Iф). С ростом концентрации ток возрастает до некоторого предельного значения, оставаясь затем постоянным. Предельный ток обусловлен тем, что в данной области потенциалов практически весь деполяризатор из приэлектродного слоя исчерпан в результате электрохимической реакции, обедненный слой обогащается за счет диффузии деполяризатора из объема раствора. Скорость диффузии в этих условиях контролирует скорость электрохимического процесса в целом. Такой ток называют предельным диффузионным. Полярограмма содержит ценную аналитическую информацию: потенциал полуволны Е1/2 является качественной характеристикой деполяризатора, в то время как предельный диффузионный ток Iд линейно связан с концентрацией его в объеме раствора ( С использованием табличных данных по Е1/2 идентифицируют деполяризатор. При затруднении расшифровки полярограмм применяют метод «свидетеля»: после регистрации полярограммы анализируемого раствора к этому раствору в электролизер поочередно добавляют стандартные растворы предполагаемых соединений. Если предположение было верным, увеличивается высота полярографической волны, при неверном – появляется дополнительная волна при другом потенциале. На рис. 2.3 представлен пример полярографической кривой (состоящей из двух волн), которая соответствует присутствию в растворе электролита двух восстанавливающихся веществ с разными потенциалами полуволны.
Рис. 2.3. Полярограмма, соответствующая содержанию в растворе электролита двух восстанавливающихся веществ с потенциалами полуволны Е11/2 и Е111/2
Помимо классического полярографического метода широко используют десятки других разновидностей вольтамперометрии (с линейной разверткой потенциала, переменную, инверсионную и др.). Предел обнаружения в вольтамперметрии равен (10-5–10-3)%, а точность измерения – около 3%. Метод кондуктометрии основан на изучении зависимости между проводимостью раствора и концентрацией ионов в этом растворе. Электрическая проводимость (электропроводность) раствора электролита является результатом диссоциации растворенного вещества и миграции ионов под действием внешнего источника напряжения. Электропроводность раствора определяется, в основном, числом, скоростью (подвижностью) мигрирующих ионов, количеством переносимых ими зарядов и зависит от температуры и природы растворителя. Метод может быть реализован в варианте прямой кондуктометрии или кондуктометрического титрования. Прямую кондуктометрию применяют для определения концентрации раствора сравнительно редко, т.к. регистрируемый сигнал не избирателен. Электропроводность раствора – величина аддитивная, поэтому ее используют для оценки чистоты растворителя, определения общего солевого состава природных и сточных вод. В кондуктометрическом титровании правильным подбором титранта и растворителя создают благоприятные условия, при которых получается кривая титрования с резким изломом. Погрешность определения конечной точки титрования невелика (2%). Нижний предел определяемых в методе концентраций составляет 10-4 моль/л. Потенциометрический метод основан на измерении электродвижущей силы (ЭДС) обратимых гальванических элементов. Его используют для определения содержания веществ в растворе. Обычно применяют два электрода (индикаторный и электрод сравнения), погруженных в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом). Потенциал индикаторного электрода зависит от активности (концентрации) определяемых ионов в растворе. В потенциометрии используют два основных класса индикаторных электродов: - электроды, на межфазных границах которых протекают реакции с участием электронов; их называют электронообменными; - электроды, на межфазных границах которых протекают ионообменные реакции; их называют мембранными или ионообменными или ионселективными. Потенциометрический анализ применяют для непосредственного определения активности ионов, находящихся в растворе (прямая потенциометрия), а также для индикации точки эквивалентности при титровании (потенциометрическое титрование). При потенциометрическом титровании могут быть использованы любые реакции, в ходе которых меняется концентрация потенциалопределяющих ионов (кислотно-основного взаимодействия, окисления-восстановления, осаждения, комплексообразования). Метод кулонометрии основан на измерении количества электричества, затраченного на электрохимическую реакцию. Последняя приводит к количественному окислению или восстановлению определяемого вещества или же к получению промежуточного реагента, который стехиометрически реагирует с определяемым веществом. Основой метода кулонометрического анализа является закон Фарадея (2.11):
где P – масса электрохимически превращенного вещества, M – молекулярная масса, Q – количество электричества, F – число Фарадея, равное 96485 Кл, n – число электронов, участвующих в электрохимической реакции.
Различают прямую кулонометрию и косвенную (кулонометрическое титрование).
Дополнительные вопросы
|

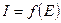 имеет форму волны (в отсутствии электрохимических реакций эта зависимость линейна, как следует из закона Ома).
имеет форму волны (в отсутствии электрохимических реакций эта зависимость линейна, как следует из закона Ома). ).
).
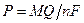 (2.11)
(2.11)


