Приготовление 250 мл приблизительно 0,1 н. раствора HCl.
Рассчитывают необходимое количество соляной кислоты. Для этого, измеряют удельный вес кислоты, определяют ее процентное содержание в растворе и рассчитывают необходимое количество (мл) HCl. Пример. Нужно приготовить 1л 0,1н. раствора HCl. Плотность кислоты, имеющейся в лаборатории, согласно определению ареометром 1,19 г/см3. По таблице находим, что соляная кислота плотностью 1,19 г/см3 содержит 38,3% HCl. Так как 1л 0,1н. раствора соляной кислоты содержит 3,646 г HCl, то получаем, что в 100 г раствора содержится 38,8 г HCl, в Х г раствора содержится 3,646 г HCl, Х = (100 · 3,646)/38,3 = 9,52 г. При пересчете найденного весового количества кислоты на объем (V) получаем: V = 9,52/1,19 = 8,0 мл. Нам нужно приготовить 250 мл раствора, поэтому количество кислоты, необходимое для приготовления раствора будет в 4 раза меньше, т.е 2,0 мл. Отмерив вычисленный объем пипеткой, переносят его в мерную колбу и доводят до метки дистиллированной водой. Полученный раствор тщательно перемешивают (табл.1). Таблица 1 Удельный вес соляной кислоты различной концентрации при 20°С
Стандартизация раствора соляной кислоты по тетраборату натрия. Титрование ведется с метиловым оранжевым, приливая кислоту из бюретки к раствору тетрабората натрия. Тщательно вымытую бюретку ополосните небольшими порциями кислоты для удаления остатков воды. Пользуясь воронкой, наполните бюретку кислотой так, чтобы мениск ее был несколько выше нулевого деления. Заполните раствором оттянутую трубку, вытеснив из нее пузырьки воздуха. Затем уберите воронку, так как с нее может капать раствор, и, выпуская лишнюю кислоту, установите нижний край мениска на нулевом делении. В таком состоянии бюретка готова к работе. Чистую пипетку вместимостью 10 мл ополосните раствором тетрабората натрия и отмерьте 10,00 мл его в коническую колбу для титрования. Не выдувайте из пипетки последнюю каплю жидкости, только прикоснитесь концом ее к стенке колбы. Прилейте к отмеренному раствору тетрабората натрия одну каплю метилового оранжевого. На основание штатива положите лист белой бумаги, подставьте колбу с исходным раствором тетрабората натрия под бюретку и приступайте к титрованию. Первое титрование считается ориентировочным. Но затем добейтесь того, чтобы желтая окраска метилового оранжевого переходила в бледно-розовую от одной избыточной капли кислоты. Титрование повторяйте до получения сходящихся результатов, т.е. пока отсчеты будут отличаться друг от друга не более чем на 0,1 мл. Все результаты титрования записывайте в журнал. Из 2-3 результатов возьмите среднее арифметическое и вычислите нормальную концентрацию раствора кислоты. Средний расход рабочего раствора равен V HCl = (V 1 + V 2 + V 3)/3, где V 1, V 2, V 3 – объем кислоты, пошедший на титрование. Так как V HCl · N 1 = V 2 · N 2, где V HCl и N 1 – объем и нормальность HCl, а V 2 и N 2 – объем и нормальность тетрабората натрия, то вычисляем по данной формуле N 1. 2.2. Определение нормальности раствора щелочи с помощью раствора соляной кислоты Нормальность раствора щелочи устанавливается по раствору соляной кислоты точной концентрации, пользуясь правилом N 1 V 1 = N 2 V 2, откуда Для определения нормальности раствора щелочи устанавливаем объемное соотношение между вступающими в реакцию растворами кислоты и щелочи. Для этого в 3 - 5 колбочек для титрования отбирают из бюретки точно отмеренные объемы раствора щелочи и титруют рабочим раствором соляной кислоты в присутствии индикатора фенолфталеина до перехода малиновой окраски в бесцветную.
2.3. Определение карбонатной жесткости воды С помощью стандартизированного раствора хлороводородной кислоты определяют не только содержание щелочей, но и некоторых солей. Большое практическое значение имеет определение карбонатной жесткости воды. Известно, что жесткость обусловлена присутствием в воде растворимых солей кальция и магния. Карбонатная жесткость зависит от содержания в воде растворимых солей кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O. Поэтому карбонатную жесткость называют также устранимой или временной. Некарбонатная жесткость вызывается присутствием в воде сульфатов (а также хлоридов) кальция или магния. Карбонатную жесткость определяют титрованием определенного объема воды раствором НСl с метиловым оранжевым. Химизм процесса выражается уравнениями Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2↑ + 2H2O, Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2↑ + H2O. Ход определения. В коническую колбу отмерьте пипеткой 100,0 мл анализируемой воды. Прибавьте 2-3 капли метилового оранжевого и титруйте раствором НСl до перехода желтой окраски индикатора в бледно-розовую. Повторите титрование 2-3 раза и из сходящихся отсчетов возьмите среднее. Удобно выполнять титрование со «свидетелем». Чтобы вычислить карбонатную жесткость (по ГОСТу) в моль на 1 л воды, находят нормальную концентрацию раствора солей и умножают ее на 1000
Допустим, что на титрование 100,0 мл воды пошло в среднем 12,25 мл 0,1016 н. раствора кислоты. Тогда Ж = (12,25 ∙ 0,1016/100)1000 = 12,45.
2.4. Определение гидроксида и карбоната натрия при совместном присутствии в растворе. Гидроксид натрия (как и другие щелочи) поглощает из воздуха оксид углерода (IV) и частично превращается в карбонат натрия 2NaOH + CO2 = Na2CO3 + H2O. Поэтому часто определяют содержание NaOH и Na2CO3 при совместном присутствии их в растворе. Титрование такого раствора кислотой можно рассматривать как процесс, протекающий в две стадии NaOH + Na2CO3 + 2НСl = 2NaCl + NaHCO3 + H2O и далее NaHCO3 + НСl = NaCl + H2O + CO2↑. Первая стадия завершается при рН 8,31, когда изменяет окраску фенолфталеин, а вторая – при рН 3,84, т.е. в области перехода метилового оранжевого. Из уравнения реакции видно, что с фенолфталеином оттитровывается весь NaOH и половина карбоната натрия. Оставшуюся половину карбоната натрия дотитровывают с метиловым оранжевым. Точность этого метода, основанного на определении двух точек эквивалентности, не превышает 1%. Объясняется это тем, что в процессе титрования раствор может поглощать оксид углерода (IV) из воздуха и часть NaOH будет превращаться в карбонат натрия. Чтобы свести до минимума это нежелательное явление, соблюдают следующие правила. Раствор щелочи разбавляют водой, свободной от оксида углерода (IV), т.е. прокипяченной и охлажденной в сосуде, имеющем поглотительную трубку с известью. Быстро переносят пипеткой раствор в коническую колбу и тотчас титруют его кислотой, избегая сильного перемешивания (усиливающего поглощение CO2 из воздуха). Для титрования приходится брать довольно много (4-5 капель) фенолфталеина, так как небольшие количества его могут обесцвечиваться еще до точки эквивалентности (под действием CO2 воздуха). Заканчивая титрование раствора с фенолфталеином, кислоту прибавляют медленно, чтобы вместо гидрокарбоната натрия не получилась угольная кислота. Ход определения В мерную колбу вместимостью 100 мл возьмите немного анализируемого раствора, разбавьте его до метки свежепрокипяченной дистиллированной водой и тщательно перемешайте. Перенесите пипеткой 10,0 мл раствора в коническую колбу и прибавьте 4-5 капель фенолфталеина, который окрасит жидкость в малиновый цвет. Титруйте его раствором НСl до обесцвечивания, которое должно произойти от одной избыточной капли кислоты. Запишите отчет. Затраченный объем кислоты соответствует всему определяемому гидроксиду натрия и половине карбоната натрия. После этого прибавьте к титруемому раствору 1-2 капли метилового оранжевого, в результате чего содержимое колбы окрасится в желтый цвет. Не доливая кислоту в бюретку, продолжайте титровать раствор до перехода желтой окраски в бледно-розовую. Запишите второй отсчет (т.е. расход кислоты на титрование половины карбоната натрия). Точное титрование с фенолфталеином и метиловым оранжевым повторите 2-3 раза и из сходящихся отсчетов возьмите средние данные. Вычислите массы NaOH и Na2CO3 в анализируемом растворе. Допустим, что после титрования раствора с фенолфталеином отсчет объема кислоты оказался равен 11,60 мл, а после титрования с метиловым оранжевым – 12,30 мл. Следовательно, на титрование половины Na2CO3 израсходовано 12,30−11,60 = 0,70 мл, а на титрование всего карбоната натрия 0,70 Например, нормальная концентрация раствора по карбонату натрия равна с (Na2CO3)10,00 = 0,1016 ∙ 1,40, с (Na2CO3) = 0,1016 · 1,40/10,00 = 0,01422, где 0,01016 – нормальная концентрация раствора кислоты. Остается вычислить массу карбоната натрия, содержащуюся в 0,1 л анализируемого раствора m (Na2CO3) = 0,01422 ∙ 53,00 ∙ 0,1 = 0,07537 г. Аналогичным образом вычисляют нормальную концентрацию раствора по гидроксиду натрия и его массу в 100 мл раствора. Раздел 3. Перманганатометрическое титрование 3.1. Сущность перманганатометрического титрования. Перманганатометрическое титрование – метод анализа, в котором титрантом служит раствор перманганата калия. В процессе титрования анализируемого раствора малиново-фиолетовая окраска раствора перманганата обесцвечивается. Однако после достижения точки эквивалентности первая же избыточная капля раствора перманганата окрашивает тируемую жидкость в розовый цвет. Индикатором в данном случае является перманганат калия. Поэтому при перманганатометрических определениях посторонние индикаторы не добавляют. Перманганат калия проявляет окислительные свойства и в кислой, и в щелочной (или нейтральной) среде. При титровании кислых растворов Mn(VII), входящий в состав KMnO4, восстанавливается до бесцветных катионов Mn2+. Например: 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O,
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O, Fe2+ - e- → Fe3+. Используют кривые окислительно-восстановительного титрования, в частности перманганатометрического титрования. Но если кривые кислотно-основного титрования показывают зависимость степени оттитрованности от рН раствора, то кривые перманганатометрического титрования выражают зависимость потенциала окислительно-восстановительной системы от степени оттитрованности, вблизи точки эквивалентности происходит резкий скачок редокс-потенциала. При титровании в щелочной или нейтральной среде Mn(VII) восстанавливается до Mn(IV), например: 5Cr2(SO4)3 + 2KMnO4 + 8KOH = 2K2CrO4 + 2MnO(OH)2↓ + 3K2SO4 + 2H2O,
Cr3+ + 8OH- -3e- → CrO42- + 4H2O, MnO4- + 3H2O + 3e- → MnO(OH)2↓ + 4OH-. Образующийся MnO(OH)2 представляет собой бурый осадок, присутствие которого в растворе затрудняет определение точки эквивалентности. Кроме того, окислительная активность перманганата калия в кислой среде гораздо выше, чем в щелочной. По этим соображениям титрование перманганатом калия чаще всего проводят в кислых растворах. Перманганатометрию используют для количественного определения не только восстановителей, но и окислителей. Восстановители, за редким исключением, определяют прямым титрованием раствором перманганата. Определяя окислители, пользуются приемом обратного титрования, т.е. к анализируемому раствору окислителя приливают заведомый избыток вспомогательного раствора восстановителя с известной концентрацией, затем остаток восстановителя оттитровывают раствором перманганата калия и делают расчет.
3.2. Приготовление стандартизированного раствора перманганата калия. Титрованный раствор перманганата калия нельзя приготовить растворением точной навески: продаваемый перманганат калия содержит ряд примесей. Кроме того концентрация перманганата калия, переведенного в раствор, заметно понижается, так как он расходуется на взаимодействие с аммиаком, органическими веществами, которые попадают в воду с пылью. Поэтому нормальную концентрацию раствора перманганата калия устанавливают обычно лишь через 5-7 дней после его приготовления. Исходными веществами для стандартизации его служат свежеперекристаллизованная щавелевая кислота H2C2O4∙2H2O или ее соли Na2C2O4 и (NH4)2C2O4∙H2O. Приготовление стандартного раствора щавелевой кислоты. Перманганат калия взаимодействует с щавелевой кислотой в сернокислой среде по уравнению
2KMnO4 + 5Н2С2О4 + 3H2SO4 = 2MnSO4 + 10СО2 + K2SO4 + 8H2O
Аналогично взаимодействует он и с оксалатами
2KMnO4 + 5Na2С2О4 + 8H2SO4 = 2MnSO4 +10СО2 + K2SO4 + Na2SO4 + 8H2O.
В этих реакциях окисляются ионы С2О42-. Каждый из них, теряя 2 электрона, превращается в две электронейтральные молекулы СО2. Mn(VII), наоборот, преобретая 5 электронов, восстанавливается до Mn(II): С2О42- - 2е- → 2СО2, MnO4- + 8H+ + 5e- → Mn2+ + 4H2O. Очевидно, молярная масса эквивалента щавелевой кислоты H2C2O4∙2H2O, которой мы воспользуемся как стандартным веществом, равна ½ молярной массы, т.е. 126,07/2 = 63,04 г/моль. Для приготовления 100 мл 0,05 н. раствора нужно взять: 63,04 ∙ 0,05 ∙ 0,1 = 0,3152 г щавелевой кислоты. Возьмите навеску H2C2O4∙2H2O на аналитических весах, растворите ее в мерной колбе вместимостью 100 мл, доведите объем раствора водой до метки и тщательно перемешайте. Вычислите титр и нормальную концентрацию исходного раствора щавелевой кислоты. Допустим, что навеска щавелевой кислоты составила 0, 2988 г, тогда Т = 0,2988/100 = 0,002988 г/мл, а нормальная концентрация с = 0,002988 ∙ 1000/63,04 = 0,04741. Приготовление 250 мл приблизительно 0,05 н. раствора перманганата калия. Нормальную концентрацию раствора перманганата устанавливают по реакции, протекающей в кислой среде. В этом случае молярная масса эквивалента KMnO4 равна158,03/5 = 31,61 г/моль. Теоретически для приготовления 0,25 л 0,05 н. раствора следовало бы взять: 31,61 ∙ 0,05 ∙ 0,25 = 0,3951 г KMnO4. Но, учитывая, что продаваемый препарат не совсем чист и, кроме того, часть перманганата расходуется на окисление присутствующих в воде восстановителей, возьмите на весах 0,4 г KMnO4. Навеску растворите в 250 мл воды следующим образом: приливайте в стакан с навеской небольшие порции горячей воды, время от времени сливая жидкость с кристаллов в специально приготовленную мерную колбу. Растворение ускоряйте путем непрерывного перемешивания. Когда вся навеска перейдет в раствор, прилейте к нему оставшуюся воду, тщательно перемешайте, закройте пробкой и оставьте стоять в темном месте. При хранении раствора на свету происходит разложение перманганата калия
4KMnO4 + 6H2O = 4MnO(OH)2↓ + 4KOH + 3О2↑.
Тот же осадок MnO(OH)2 выделяется в результате взаимодействия перманганата с восстановителями. Через 5-7 дней раствор, титр которого станет постоянным, осторожно слейте с осадка в другую склянку. Он нуждается еще в установке нормальной концентрации по исходному веществу. Стандартизация раствора перманганата калия по щавелевой кислоте. Хорошо вымытую бюретку промойте раствором перманганата калия и подготовьте к титрованию. Ополосните пипетку раствором щавелевой кислоты и перенесите 10,00 мл его в коническую колбу. Прибавьте 8-10 мл 2 н. серной кислоты, нагрейте до 70-80 ºС (не допуская кипения, при котором щавелевая кислота разлагается) и горячий раствор титруйте перманганатом калия. Раствор перманганата калия приливайте медленно, по каплям, при непрерывном перемешивании. Каждую следующую каплю добавляйте лишь после того, как обесцветилась предыдущая. Первоначально обесцвечивание перманганата будет происходить медленно, но затем по мере образования сульфата марганца, играющего роль катализатора, оно ускорится. Титрование прекратите, когда избыточная капля перманганата сообщит раствору бледно-розовую окраску, не исчезающую в течение 1-2 мин. Объемы раствора перманганата калия отсчитывайте по верхнему краю мениска, так как нижний плохо виден. Повторите титрование 2-3 раза, из сходящихся отсчетов возьмите среднее значение и вычислите нормальную концентрацию раствора перманганата калия. Например, если на титрование 10,00 мл 0,04741 н. раствора щавелевой кислоты пошло в среднем 9,15 мл раствора перманганата калия, нормальная концентрация его
с (KMnO4) = 0,04741 ∙ 10,00/9,15 = 0,05181.
|

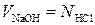

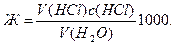
 2 = 1,40 мл раствора кислоты. Тогда на титрование NaOH израсходовано 12,30 – −1,40 = 10,90 мл раствора кислоты. Эти данные позволяют вычислить нормальную концентрацию анализируемого раствора по NaOH и Na2CO3, а также содержание их в растворе.
2 = 1,40 мл раствора кислоты. Тогда на титрование NaOH израсходовано 12,30 – −1,40 = 10,90 мл раствора кислоты. Эти данные позволяют вычислить нормальную концентрацию анализируемого раствора по NaOH и Na2CO3, а также содержание их в растворе.


