
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
ЛАБОРАТОРНА РОБОТА №6
Дата добавления: 2014-10-22; просмотров: 628
|
|
| Тема: | Визначення реакції середовища за допомогою індикаторів. | |
| Мета: | Освоїти методику визначення реакції середовища експрес – методом. | |
| Реактиви: | Розчини: | - Сульфатна (сірчана) кислота; |
| - Калій гідроксид. | ||
| Обладнання: | Хімічний штатив з пробірками, бюретка, універсальний індикатор. |
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Вода – слабкий електроліт. Ступінь дисоціації води при 22 0С α 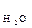 = 1,8 · 10-9. Це означає, що у воді об’ємом 1л (1л містить 55 моль води: 1000 г/ (18г · моль-1) = 55 моль) при 22 0С , стільки 10-7 моль дисоціює на іони:
= 1,8 · 10-9. Це означає, що у воді об’ємом 1л (1л містить 55 моль води: 1000 г/ (18г · моль-1) = 55 моль) при 22 0С , стільки 10-7 моль дисоціює на іони:
Н2О  Н+ + ОН-
Н+ + ОН-
Внаслідок цього утворюється 10-7 моль гідроген-іонів і 10-7 моль гідроксид іонів. Таким чином, концентрація гідроген- і гідроксид-іонів у воді однакові і при температурі 220С дорівнюють [Н+] = [ОН-] = 10-7 моль/л. Добуток концентрацій гідроген- і гідроксид-іонів називають іонним добутком води (I  ). При 220С ця величина становить
). При 220С ця величина становить
I  = [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14
= [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14
Іонний добуток води залежить від температури: з її підвищенням він збільшується, із зниженням – зменьшується. Будь-який розчин кислоти, лугу або солі містить гідроген- та гідроксид-іони. Концентрація гідроген-іонів визначає кислотність розчину (середовища), а концентрація гідроксид-іонів – лужність.
Розчини, в яких концентрація гідроген- і гідроксид-іонів однакові і дорівнюють 10-7 моль/л, називають нейтральними.
Якщо до нейтрального розчину додати кислоту (НА  Н+ + А-), концентрація гідроген-іонів у розчині збільшиться. Внаслідок цього рівновага Н2О
Н+ + А-), концентрація гідроген-іонів у розчині збільшиться. Внаслідок цього рівновага Н2О  Н+ + ОН- зміститься вліво, а, значить, концентрація гідроксид-іонів зменьшиться в стільки разів, у скільки зросте концентрація гідроген-іонів.
Н+ + ОН- зміститься вліво, а, значить, концентрація гідроксид-іонів зменьшиться в стільки разів, у скільки зросте концентрація гідроген-іонів.
Розчини, в яких концентрація гідроген-іонів перевищує концентрацію гідроксид-іонів [Н+] >[ОН-], називають кислими. Розчини, де концентрація гідроген-іонів меньша, ніж гідроксид іонів [Н+] <[ОН-], є лужними.
У кислих і лужних розчинах добуток концентрацій іонів [Н+] [ОН-] – стала величина за сталої температури, [Н+] [ОН-] = 10-14. Тому, знаючи концентрацію одного з цих іонів, можна легко визначити концентрацію іншого. Наприклад, знайдемо концентрацію гідроген- і гідроксид-іонів в 0,01 М розчині HCl. Рівняння дисоціації : HCl  H+ + Cl-. Будемо вважати, що ступень дисоціації α(HCl) = 100%. Отже, [Н+] = 10-2 моль/л, тоді
H+ + Cl-. Будемо вважати, що ступень дисоціації α(HCl) = 100%. Отже, [Н+] = 10-2 моль/л, тоді
[ОН-] = 10-14 /10-2 = 10-12 моль/л
Кислотність розчину звичайно виражають через концентрацію гідроген-іонів. Для зручності замість концентрації гідроген-іонів використовують водневий показник рН.
Водневий показник рН – це від’ємний десятковий логарифм концентрації гідроген-іонів, рН = - lg [Н+]. Наприклад, при [Н+] = 10-1, рН = 1; при [Н+1] = 10-5, рН = 5 і т.д.
Знаючи концентрацію гідроген-іонів, можна визначити рН розчину і навпаки. У нейтральних розчинах [Н+] = [ОН-] = 10-7 моль/л, рН = 7. У кислих розчинах [Н+] >10-7 моль/л, рН < 7. У лужних розчинах [Н+] <10-7 моль/л, рН > 7.
Кислотність розчину можна визначити за допомогою індикаторів – речовин, які змінюють свій колір залежно від рН. Зміна кольору індикаторів відбувається в певному інтервалі значень рН. Кожний індикатор характеризується своїм інтервалом переходу (Таблиця 1)
Таблиця 1
| 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 рН | |||
| Лакмус | Червоний | Інтервал переходу | Синій |
| Фенолфталеїн | Безбарвний | Інтервал переходу | Малиновий |
| Метиловий оранжевий | Червоний | Інтервал переходу | Жовтий |
Існують універсальні індикатори, за допомогою яких можна визначити будь-яке значення рН з точністю до одиниці.
Багато промислових, хімічних і біологічних процесів відбуваються лише за певних значень рН розчину.
1.2 Проведення дослідів
| <== предыдущая лекция | | | следующая лекция ==> |
| ЛАБОРАТОРНА РОБОТА № 5 | | | ЛАБОРАТОРНА РОБОТА №7 |