
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Приклади розв’язання задач
Дата добавления: 2014-11-10; просмотров: 3875
|
|
Приклад 1.У 80-х роках ХХ ст. середньорічна концентрація діоксиду карбону в атмосфері, що приведена до температури 273 К і тиску повітря 101,3кПа, досягла 340 млн-1. Визначте концентрацію СО2 в % (об.), см-3, моль/л, мг/м3 і Па при середній температурі повітря у приземному шарі Землі.
Розв’язок:Перерахуємо концентрацію СО2 з млн-1 на % (об.):
C=С´∙10-4
де С´ – концентрація СО2 виражена в млн-1, або ppm; 10-4 – коефіцієнт переводу млн.-1 (або ppm) в % (об.).
C=340∙10-4=3,4∙10-2% (об.)
За нормальних умов (температура 0ºС, тиск – 101,3кПа) в 1см3 газу міститься 2,69·1019 молекул (цю величину часто називають числом Лошмідта). Це число отримано при ділені загального числа молекул в 1молі любого газу (число Авогадро) на об‘єм, що займає ця кількість газу (молярний об‘єм газу Vм), виражений в кубічних сантиметрах:
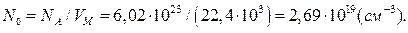
Оскільки молярний об‘єм газу змінюється в залежності від температури і тиску газу, при температурі Т і атмосферному тиску Р число молекул в 1см3 любого газу складає:
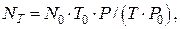
де NT і N0 – число молекул в 1см3 будь-якого газу при заданих і нормальних умовах відповідно; T0, P0 і T, P – температура і тиск при нормальних і заданих умовах відповідно.
При 15ºС (288К) і нормальному атмосферному тиску загальна кількість молекул ідеального газу або суміші ідеальних газів в 1см3 складає :
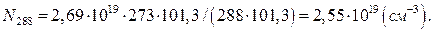
Приймемо, що повітря і діоксид карбону є ідеальними газами. Тоді кількість молекул діоксиду карбону в 1см³ повітря (NСО2) можна визначити за формулою:
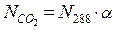
де α – об’ємна частка діоксиду карбону в повітрі;
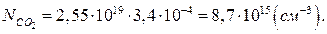
Визначимо парціальний тиск діоксиду карбону в повітрі. Значення об’ємних концентрацій сумішей приводяться зазвичай в перерахунку на сухе повітря. при визначенні парціального тиску в реальних умовах слід враховувати парціальний тиск парів води, які завжди присутні в атмосферному повітрі. Тому необхідно скористатись наступним рівнянням:
р=(Рпов. – Рводи)∙α
де р – парціальний тиск газу в повітрі, кПа; Рпов – атмосферний тиск, кПа; Рводи – парціальний тиск парів води в атмосферному повітрі, кПа; α – об’ємна частка газу в повітрі.
При 15ºС парціальний тиск водяної пари в повітрі складає 1704,91Па (табл. А.2). парціальний тиск діоксиду карбону в повітрі становитиме:
р=(101,3 – 1,7)∙3,4∙10-4=3,39∙10-2(кПа)=33,9 (Па)
Кількість молів діоксиду карбону в 1л повітря визначимо за рівнянням:
ССО2 =р/(RT),
де ССО2 – концентрація діоксиду карбону, моль/л; P – парціальний тиск діоксиду карбону, кПа; R – універсальна газова стала, л·кПа/(моль·К); T – температура повітря, К;
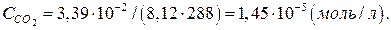
Кількість міліграмів діоксиду карбону в 1м3 повітрі складає:
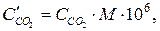
де М – молярна маса СО2, г/моль; 106 – коефіцієнт перерахунку концентрації з грамів в літрі на міліграми в кубічному метрі.
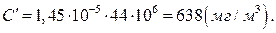
Відповідь: концентрація діоксиду карбону в повітрі становить: 0,034% (об.); 8,7·1015 см-3; 1,45·10-5 моль/л; 638 мг/м3; парціальний тиск діоксиду карбону становить 33,9 па.
Приклад 2.Маса атмосфери оцінюється величиною 5·1015т. Визначте масу кисню в атмосфері припустивши, що атмосфера складається тільки з «квазіпостійних» компонентів, таких як азот, кисень і аргон, а їх об’ємна концентрація відповідає значенню, характерному для приземного шару атмосфери.
Розв’язок:Для розв’язку задачі на першому етапі необхідно розрахувати середню молярну масу повітря Мпов:
 Мпов = МN2·αN2+ МO2·αO2+МAr·αAr
Мпов = МN2·αN2+ МO2·αO2+МAr·αAr
де МN2, МO2, МAr – молярна маса азоту, кисню і аргону; αN2, αO2, αAr – об’ємні частки відповідних компонентів в повітрі.
Мпов = 28,01·0,7808+32,00·0,2095+39,95·0,00934=28,95(г/моль).
За відомою масою атмосфери Q(г) і середньою молярною масою повітря Мпов (г/моль) визначимо загальну кількість молів повітря в атмосфері nпов:
nпов= Q/Мпов;
nпов = 5·1015·106/28,95 = 1,7·1020(моль),
де 106 – коефіцієнт переводу тонни в грами.
Оскільки мольні і об’ємні долі газів в суміші рівні між собою, можна знайти кількість молів і масу кисню в атмосфері:
nО2=nпов.·αО2=1,7·1020·0,2095=3,6·1019(моль).
QО2= nО2·МО2=3,6·1019·32=1,15·1021(г).
Відповідь:маса кисню в атмосфері дорівнює 1,15·1015(т).
Приклад 3. В скільки разів кількість молекул кисню в 1см3 повітря на висоті вершини Ельбрус (5621м над рівнем моря) менше ніж середнє значення біля поверхні Землі (на рівні моря) при нормальному атмосферному тиску та середній температурі повітря?
Розв’язок:Кількість молекул, що знаходяться в 1см3 повітря (nпов), можна знайти за формулою:
nпов=NAT0P/ТР0Vm,
де NA – число Авогадро; Vm – молярний об’єм газу за нормальних умов; T0, Р0 і P, Т – значення температури (К) і тиску при нормальних і заданих умовах відповідно.
Тиск біля поверхні Землі (на рівні моря) за заданих умов дорівнює тиску за нормальних умов (P=Р0). Середня температура повітря біля поверхні Землі (на рівні моря) дорівнює 288К. В цьому випадку кількість молекул газу в 1см3 повітря становить:
nпов=6,02·1023·273/288·22,4·103 = 2,55·1019 (см-3).
Кількість молекул кисню в 1см3 повітря біля поверхні Землі (на рівні моря) при нормальному атмосферному тиску, середній температурі біля поверхні Землі і середньому значенні концентрації кисню в приземному шарі атмосфери становить:
nО2(З)=nпов.·αО2,
де αО2 – середнє значення концентрації кисню в приземному шарі, виражене в об’ємних долях:
nО2(З) =2,55·1019·0,2095=5,34·1018 (см-3).
Вміст молекул повітря в атмосфері спадає зі збільшенням висоти над рівнем моря:
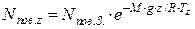
де nпов. z – концентрація молекул в повітрі на висоті z, см-3; nпов. З – середня концентрація молекул в повітрі на рівні моря, см-3; M – середня молярна маса повітря, кг/моль; g – прискорення сили тяжіння, м/с2; z – висота над рівнем моря, м; R – універсальна газова стала, Дж/(моль·К); Тz – середня температура повітря на висоті z, К.
Температура на заданій висоті в тропосфері можна оцінити за допомогою рівняння:
Тz=ТЗ + γ·z,
де Тz, ТЗ – температура на заданій висоті z і біля поверхні Землі відповідно, К; γ – вертикальний температурний градієнт в стандартній тропосфері (γ=-6,5К/км).
Середня температура атмосфери на висоті вершини Ельбрус становить:
Тz=288 + (-6,5)·5,621 = 251,5 (К).
Концентрація молекул повітря на висоті вершини Ельбрус становить:
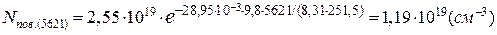
Оскільки співвідношення числа молекул «квазіпостійних» компонентів повітря в одиниці об’єму практично не змінюється в атмосфері до висоти 100км, можна визначити концентрацію молекул кисню на висоті вершини Ельбрус:
nО2(z) = nпов. z·αО2;
nО2(z) = 1,19·1019·0,2095 =2,49·1018(см-3).
Співвідношення кількості молекул кисню в повітрі біля поверхні Землі (на рівні моря) і кількості молекул кисню в повітрі на вершинні гори Ельбрус становить:
Х=nО2 (З)./nО2(z) ;
Х=5,34·1018 /(2,49·1018)=2,1.
Відповідь: концентрація молекул кисню в повітрі на вершині Ельбрус в 2,1 раз менше ніж біля поверхні Землі.
Приклад 4.Визначте середній час знаходження парів води в атмосфері, якщо за оцінками спеціалістів в атмосфері міститься 12900км3 води, а на поверхню суші і океану випадає у вигляді атмосферних опадів в середньому 577·1012 м3 в рік.
Розв’язок: Середній час знаходження компонентів в атмосфері в умовах динамічної рівноваги можна визначити за рівнянням:
τ = А/Q,
де τ – час перебування речовини в атмосфері, в одиницях часу; А – кількість речовини в атмосфері, в одиницях маси; Q – швидкість надходження або виведення речовини з атмосфери, в одиницях маси на одиницю часу.
τ=12900·109/(577·1012)= 2,24·10-2 роки = 8,2 доби,
де 109 – коефіцієнт переводу кубічних кілометрів в кубічні метри.
Відповідь: середній час знаходження води в атмосфері складає 8,2 доби.
| <== предыдущая лекция | | | следующая лекция ==> |
| Хімічний склад атмосфери | | | Задачі для самостійного розв’язання |