
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Задачі для самостійного розв’язання
Дата добавления: 2014-11-10; просмотров: 880
|
|
задача 1.Опинившись у верхніх шарах атмосфери, вода фотодисоціює з утворенням активних компонентів атмосфери – гідроксидного радікалу та атомарного кисню, які беруть участь у багатьох процесах окиснення і процесах руйнації озону:
Н2О + hn®Н + НО 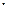
Н2О + hn → Н + Н + О
Визначте максимальну довжину хвилі випромінювання, здатного викликати дисоціацію молекули води за першою і другою реакціями. Прийняти, що вся енергія фотону витрачається на процес дисоціації, а енергія зв’язку для одного моля води, яка дорівнює 493,2кДж для першої реакції і 916,5кДж для другої, еквівалентна енергії дисоціації.
задача 2.Напишіть формули фреонів Ф-21, Ф-113 і Ф-123. Розташуйте фреони в порядку зростання їх впливу на руйнацію озону в атмосфері.
задача 3.Запишіть в кодованій формі фреону наступні фторхлорвуглеводні: a) СН3ССl2F; б) СF3СНСl2; в) CF2Cl2; г) CHF2Cl. Який з цих фреонів найбільш небезпечний для озонового шару?
задача 4.Оцініть час напіввиведення монооксиду нітрогену з атмосферного повітря при його окисненні: а) киснем; б) озоном. Який з цих окисників вносить основний вклад в процес виводу NO з атмосфери, якщо концентрації газів складають (% об.): NO – 4,1∙10-8; О2 – 20,95; О3 – 1∙10-6? Константи швидкості реакцій окиснення монооксиду нітрогену киснем та озоном дорівнюють відповідно: kкисн=1,93·10-38см6·с-1; kозон=1,8·10-14см3·с-1. Температура повітря 25°С, тиск 1,1атм.
задача 5. Порівняйте швидкості виведення з атмосфери молекул метану при їх взаємодії з гідроксидним радикалом в приземному шарі і на висоті верхньої межі стандартної тропосфери. Концентрація метану на цих висотах дорівнює 1,7% (об.). Енергія активації і предекспоненціальний множник для реакції взаємодії метану з ОН-радикалом дорівнюють 14,1кДж/моль і 2,3см3·с-1 відповідно. Концентрації гідроксидних радикалів на цих висотах прийняти рівними: [ OH]1=5·105см-3, [
OH]1=5·105см-3, [ ОН]2=2·106см-3.
ОН]2=2·106см-3.
задача 6. Якого максимального значення можуть досягти концентрація і парціальний тиск озону в приземному шарі повітря, якщо він утворений при окисненні метану в присутності оксидів Нітрогену (концентрація метану дорівнює 1,6∙10-4% (об.)? При оцінці прийняти, що озон з атмосфери не виводився. Відповідь дайте в см-3, мг/м3, млн.-1 і Па. Температура повітря 20°С, тиск 710мм рт. ст.
задача 7. Визначте, яким буде співвідношення швидкостей процесів газофазного й рідкофазного окиснення SO2, якщо прийняти, що основний вклад вносять наступні реакції:
SO2(г)+ OH(г)
OH(г) 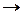
 HSO3(г)
HSO3(г)
SO2(p-н)+H2O2(p-н) 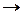 H2SO4(p-н).
H2SO4(p-н).
Концентрація домішок в газовій фазі складає: [ ОН]=5·106см-3; [SO2]=1·10-4% (об.); [Н2О2]=1·10-7% (об.). Константи швидкостей реакції окиснення: k1=9·10-13см3·с-1; k2=1·103л·с-1. Розрахунки провести для атмосферного повітря, що має температуру 25°С й містить в своєму складі 1·10-2г/м3 вільної води. Прийняти, що при розчиненні у воді концентрація SО2 в газовій фазі не змінюється. Гази вважати ідеальними і такими, що підпорядковуються закону Генрі. Тиск прийняти рівним 1,1атм.
ОН]=5·106см-3; [SO2]=1·10-4% (об.); [Н2О2]=1·10-7% (об.). Константи швидкостей реакції окиснення: k1=9·10-13см3·с-1; k2=1·103л·с-1. Розрахунки провести для атмосферного повітря, що має температуру 25°С й містить в своєму складі 1·10-2г/м3 вільної води. Прийняти, що при розчиненні у воді концентрація SО2 в газовій фазі не змінюється. Гази вважати ідеальними і такими, що підпорядковуються закону Генрі. Тиск прийняти рівним 1,1атм.
задача 8. Яким би було співвідношення концентрацій NO і NO2 в рівноважній системі на висоті 11км, якщо їх взаємну трансформацію можна було б обмежити наступними рівняннями:
NO+O+M 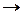 NO2+M*
NO2+M*
NO2+O 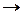 NO+O2
NO+O2
Константи швидкостей реакції: k1=8·10-32 см6·с-1, якщо М – молекули кисню; k2=1·10-12 см3·с-1.
Які ще реакції характеризують атмосферну трансформацію оксидів Нітрогену?
задача 9*. Розрахуйте період напіввиведення діоксиду нітрогену з атмосферного повітря за реакцією:
NO2(г) +∙ОН(г) → НNO3
концентрація гідроксидного радикалу – 2,4·106см-3; константа швидкості реакції – k=2,0·10-11см3·с-1.
задача 10*. В умовах підвищеної вологості SO2 окиснюється зі швидкістю 30% (мас.) за годину за реакцією:
SO2(p-н)+H2O2(p-н) 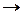 H2SO4(p-н).
H2SO4(p-н).
Константа швидкості реакції окиснення k=1·103л·моль-1·с-1. Оцініть концентрацію H2O2 у воді за умови, що SO2 і H2O2 реагують у стехіометричному співвідношенні.
задача 11*. Використовуючи метод стаціонарних концентрацій, знайдіть співвідношення концентрацій NO і NO2, якщо їх взаємну природну трансформацію обмежити наступними реакціями:
NO+O+M 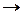 NO2+M*
NO2+M*
NO2+O 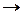 NO+O2
NO+O2
Константи швидкостей реакції: k1=8·10-32 см6·с-1, k2=1·10-12 см3·с-1. Концентрацію третьої речовини М прийняти рівною 1·1013 см-3.
Яка роль оксидів Нітрогену в глобальних екологічних проблемах?
Задача 12*. Яка кількість оксиду Нітрогену може виділитися в атмосферу з поверхні океану (S=361,1·106км2) в результаті протікання фотохімічного розкладання іонів NO3-? Концентрація іонів NO3- у верхньому десятиметровому шарі океану дорівнює 2мкМ. В середньому за добу розкладається 10% іонів NO3-. Оцініть вклад цього процесу в забруднення атмосфери оксидами Нітрогену, якщо відомо, що природні надходження NOх складають за рік 18млн. т, а антропогенні викиди – 19млн. т в перерахунку на Нітроген. Прийняти концентрацію NO3- у верхньому шарі океану постійною.
задача 13*. Як залежить швидкість руйнації озону в хлорному циклі (джерелом атомарного Хлору є фреон-11) від інтенсивності потоку сонячного випромінювання у випадку, якщо обрив реакційного ланцюгу відбувається: а) в результаті рекомбінації атомів Хлору; б) при взаємодії з молекулами метану?
задача 14*. Який взаємозв’язок між руйнацією озонового шару і утворенням фотооксидантів в тропосфері? Поясніть характер зворотних зв’язків.
Контрольні запитання
1. Дайте характеристику будови і хімічного складу атмосфери. Що таке квазіпостійні компоненти і „активні” домішки атмосфери?
2. Як змінюється вміст основних компонентів атмосфери з висотою?
3. Від чого залежить тривалість перебування домішок в атмосфері?
4. Назвіть основні хімічні процеси, що відбуваються в атмосфері.
5. Чому вільні радикали, озон та інші окисники, концентрація яких значно нижче ніж кисню, відіграють головну роль в процесах окиснення домішок в атмосферному повітрі? Назвіть основні джерела утворення і стоку гідроксидного і гідропероксидного радикалів в атмосфері.
6. Що Ви можете сказати про добові та сезонні зміни озону в атмосфері. Проаналізуйте причини утворення «озонових дир» над Антарктидою.
7. Опишіть механізм утворення озону. Що таке «нульовий» цикл озону? Які процеси приводять до порушення «нульового» циклу озону?
8. Які процеси приводять до обриву хлорного, гідрогенного і нітрогенного циклів? Наведіть приклади реакцій. Як змінюються основні шляхи стоку і час життя хлорфторвуглеводнів в залежності від їх складу?
| <== предыдущая лекция | | | следующая лекция ==> |
| Приклади розв’язання задач | | | ЛАБОРАТОРНИЙ ПРАКТИКУМ |