
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Навколишнє середовище
Дата добавления: 2014-11-10; просмотров: 2369
|
|
Хоча на верхні зони атмосфери припадає лише невелика частина всієї її маси, саме ці верхні шари в значній мірі визначають умови життя на землі. Вони відіграють роль передового бастіону, який захищає нашу планету від потоку променів і граду частинок високої енергії. Однак у результаті такої взаємодії молекули і атоми атмосфери піддаються хімічним перетворенням.
Одним з найбільш цікавих фотохімічних процесів, які відбуваються в стратосфері, є фотодисоціація води. Парціальний тиск водяної пари в атмосфері дуже великий поблизу поверхні Землі, але швидко зменшується зі збільшенням висоти. Вміст водяної пари в стратосфері на висоті 30км складає всього три молекули на мільйон (3ррm). Хоча вміст водяної пари на ще більших висотах не вдалося виміряти, можна передбачити, що він не перевищує декількох мільйонних ррm.
Опинившись у верхніх шарах атмосфери, вода фотодисоціює з утворенням активних компонентів атмосфери – гідроксидного радікалу та атомарного кисню, які беруть участь у багатьох процесах окиснення, в хімії стратосферного озону:
Н2О(г)+ hn®Н(г)+ НО 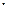 (г) (3.5)
(г) (3.5)
НО  (г)+ hn®Н(г)+О(г) (3.6)
(г)+ hn®Н(г)+О(г) (3.6)
Деякі вчені вважають, що на ранніх стадіях історії Землі, коли вона ще не мала кисневої атмосфери, фотодисоціація води відіграла відповідну роль у формуванні кисневої атмосфери.
Ще одним важливим процесом, який відбувається в верхніх шарах атмосфери, є фотодисоціація молекул кисню, що описується рівнянням:
О2+hn®О(1D) +О(3P) (3.7)
Залежно від енергії поглиненого кванта атом кисню, що утворюється за реакцією (3.7), може знаходитися в збудженому О(1D) або в основному стані О(3P). Атом, що знаходиться в основному стані, здатний вступити в реакцію синтезу озону:
О(3P)+О2+М®О3+М* (3.8)
Реакція відбувається за участю третьої речовини М, якій і передається зайва енергія. Участь збуджених атомів кисню в реакції (3.8) не призводить до синтезу озону, оскільки в цьому випадку навіть перерозподілом енергії за участю третьої речовини М не вдається стабілізувати молекулу озону.
реакція за участю «непарного кисню» призводить і до стоку озону із стратосфери:
О3+О®2О2 (3.9)
Проте швидкість цієї реакції значно нижче швидкості реакції утворення озону, тому внесок реакцій за участю «непарного кисню» в процеси виведення озону з атмосфери незначний. Реакції утворення (3.8) і розкладання (3.9) озону часто називають нульовим циклом озону.
Гази, що реагують з атомарним киснем стратосфери, також можуть перешкоджати утворенню озону і бути відповідальними за виснаження озонового шару. Значний внесок в процес руйнування озону вносять ланцюгові процеси, що протікають за участю гідроксидних радикалів (гідрогенний цикл), оксидів Нітрогену (нітрогенний цикл), сполук хлору і брому (хлорний і бромний цикли).
Гідрогенний цикл. Шлях молекул води із тропосфери в стратосферу непростий, оскільки, відповідно до законів атмосферної динаміки, перенос повітряних мас через тропосферу практично не відбувається, за винятком потужних купчастих хмар. Під дією УФ-випромінювання молекули води руйнуються (реакція 3.5), утворюючи гідроксид ний радикал 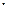 ОН, що і дає початок гідрогенному циклу.
ОН, що і дає початок гідрогенному циклу.
Гідроксидні радикали утворюються також при взаємодії молекул води або метану із збудженим атомом кисню:
Н2О+О(1D)®2НО 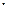 (3.10)
(3.10)
СН4+О(1D)® 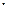 СН3 + НО
СН3 + НО 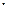 (3.11)
(3.11)
Гідроксидний радикал, що утворився в цих процесах, може вступити в реакцію з озоном. Продуктами цієї взаємодії є гідропероксидний радикал і молекула кисню. Гідропероксидний радикал при взаємодії з атомарним киснем в основному стані утворює молекулу кисню і гідроксидний радикал. Гідрогенний цикл замикається, але при цьому повністю порушується нульовий цикл озону:
НО 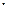 +О3 ®НО2
+О3 ®НО2 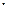 +О2 (3.12)
+О2 (3.12)
НО2 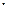 +О(3P)®НО
+О(3P)®НО 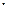 +О2 (3.13)
+О2 (3.13)
—————————
О3 +О(3P)®2О2 (3.14)
Нітрогенний цикл. монооксид нітрогену при взаємодії з озоном окиснюється до діоксиду нітрогену, але при взаємодії NO2 з атомарним киснем в незбудженому стані знов утворюється монооксид нітрогену. Нітрогенний цикл замикається, але при цьому порушується нульовий цикл озону:
NO+О3 ® NO2+О2 (3.15)
NO2+О(3P) ® NO+О2 (3.16)
—————————
О3 +О(3P) ®2О2 (3.17)
Це так званий нітрогенний цикл Крутцена. З цієї послідовності реакцій видно, що NО збільшує швидкість розкладення О3. Хімічний стан NО в кінцевому результаті не змінюється, тобто він діє як каталізатор. Необхідний для другої реакції атомарний кисень може утворюватися як в результаті реакції фотодисоціації кисню та води, що було розглянуті вище, так і в реакції фотодисоціації діоксиду нітрогену:
NO2 + hv → NO + O (3.18)
Остання реакція, на відміну від реакції фотодисоціації молекул кисню, яка потребує фотонів світла з λ≤240нм, протікає навіть під дією «м'якого» ультрафіолетового випромінювання (межа дисоціації NO2 відповідає довжині хвилі випромінювання 400нм), що може проникати аж до поверхні Землі.
Необхідно відзначити, що небезпеку для озонового шару становлять оксиди Нітрогену, що утворюються тільки безпосередньо в стратосфері. NО і NO2, що викидаються з наземних джерел або утворюються в тропосфері, мають малий час життя і не встигають досягти стратосфери. Серед оксидів Нітрогену, які утворюються на поверхні Землі, небезпеку для озонового шару становить лише геміоксид нітрогену (N2O), у якого достатньо великий час життя, і тому він здатний подолати глобальний інверсійний бар’єр та досягти зони максимальної концентрації озону. Цей газ утворюється в процесах денитрифікації в ґрунті, а також в процесах горіння, наприклад, в автомобільних двигунах з каталітичним перетворювачем. при взаємодії із збудженим атомом кисню геміоксид нітрогену перетворюється на монооксид нітрогену, який далі ініціює нітрогенний цикл розкладання озону:
N2O+О(1D)®2NO (3.19)
Останнім часом вивчається питання про вплив на озоновий шар атмосфери надзвукових транспортних літаків (НЗТЛ), які літають в стратосфері. В двигунах внутрішнього згорання розвиваються настільки високі температури, що з атмосферного кисню і азоту утворюється NО:
N2+О2®2NО (3.20)
Ця реакція ендотермічна і швидкість її за звичайних умов дуже мала, але при високих температурах вона протікає вже з вимірюваною швидкістю, тому в двигунах НЗТЛ утворюється значна кількість монооксиду нітрогену, який буде викидатися в стратосферу, де концентрація озону велика. Широке використання НЗТЛ в усьому світі призвело до утворення такої кількості NО, яка здатна значно знизити повний вміст озону в стратосфері, а особливо над районами Землі, які знаходяться під найбільш інтенсивними маршрутами руху літаків.
Хлорний цикл. Фторхлорметани, або фреони (технічна назва групи насичених аліфатичних галогеновмісних вуглеводнів загальної формули СFхСl4-х), головним чином СF2Сl2 і СFСl3, також можуть виявляти негативну дію на озоновий шар. Ці речовини широко використовувалися в якості газоподібних хладоагентів в холодильних установках, при виробництві пінопласту і каучуку, у виготовленні різних побутових товарів в аерозольних упаковках. Вони настільки інертні в хімічному відношенні, що важко уявити собі якісь порівняно швидкі хімічні процеси, які можуть виводити фторхлорметани з нижніх шарів атмосфери. Тому тривале перебування молекул цих речовин в атмосфері визначається швидкістю, з якою вони розсіюються в стратосферу і зазнають там дії короткохвильового ультрафіолетового випромінювання. Дія світла високої енергії з довжинами хвиль в діапазоні від 190 до 225нм призводить до фотолізу фторхлорметанів, до розриву під дією фотонів світла зв’язків між атомами Карбону та Хлору:
СFхСl4-х +hn® ∙СFхСl3-х +Cl (3.21)
Можливе подальше фотохімічне розкладення фрагменту ∙СFхСl3-х. Розрахунки показують, що швидкість утворення атомів хлору повинна бути максимальною на висоті 30км. Атомарний хлор, який утворився в результаті фотолізу, може швидко реагувати с озоном, утворюючи молекулярний кисень і оксид хлору, який, в свою чергу, може реагувати з атомарним киснем, що знаходиться в незбудженому стані, в результаті чого знову утворюється атомарний хлор:
Cl+О3®ClО+О2 (3.22)
ClО+О(3P) ®Cl+О2 (3.23)
________________
О3+О(3P) ®2О2 (3.24)
Хлорний цикл замикається, а нульовий цикл озону порушується.
Ця пара реакцій аналогічна реакціям з участю гідроксидного радикалу та монооксиду нітрогену, й призводить до результуючої реакції – розпаду озону. Істотно, що швидкість розпаду озону в хлорному циклі приблизно в 6 разів більша, ніж в нітрогенному.
Важливим моментом в хімії стратосферного озону у цих ланцюгових реакціях є те, що одна молекула забруднювача може бути причиною руйнування великої кількості молекул озону. В усіх випадках відбувається регенерація початкових частинок ОН, NO, CI, які можуть розглядатися як каталізатори процесу руйнування озону. Так, один атом хлору призводить до розкладання 100тис. молекул озону.
Відповідно до монреальського протоколу і інших додаткових міжнародних протоколів виробництво озоноруйнуючих фреонів практично припинено. Але, оскільки швидкість дифузії молекул від земної поверхні в стратосферу дуже невелика, може пройти ще декілька десятиріч, протягом яких буде відчуватися дія фторхлорметанів. Причиною цьому є й досить тривалий час «життя» озоноруйнуючих газів: для фреонів він становить 80 років, тетрахлорметану – 50 років, газів, які містять в складі молекули атоми Гідрогену, – близько 10 років. Отже, навіть при повному припиненні використання цих газів, їх вплив ще довго буде позначатися на концентрації озону в атмосфері.
Замість фреонів в даний час у відповідних галузях промисловості використовуються часто менш ефективні, але більш безпечні органічні сполуки. Наприклад, введення в молекулу хлорфторвуглеводню атомів Гідрогену, робить сполуки більш реакційноспроможними, час життя в тропосфері, як відзначалося вище, значно зменшується, і такі сполуки вже не здатні досягти стратосфери і вплинути на вміст в ній озону. Інший шлях пов'язаний з повною або частковою заміною атомів хлору в молекулі фреону. В цьому випадку молекула або може стати більш реакційноспроможною (із зменшенням часу життя), або вона не представлятиме небезпеки для озонового шару, оскільки хлорний цикл за відсутністю хлору неможливий.
Бромний цикл. Атом брому подібно атому хлору здатний при взаємодії з озоном утворювати оксид брому і молекулу кисню. Проте на відміну від оксиду хлору ВrО може вступити також в реакцію з іншою молекулою оксиду брому або з оксидом хлору:
Вr+О3®ВrО+О2 (3.25)
ВrО+ВrО®2Вr+О2 (3.26)
ВrО+ClО®Вr+Cl+О2 (3.27)
У всіх розглянутих до цього циклах руйнування озонового шару реакція за участю атомарного кисню є найповільнішою, і її швидкість лімітує відповідні цикли. У разі бромного циклу процес значно прискорюється, і бром потенційно найбільш небезпечний для озонового шару. Дослідження показали, що озоноруйнуюча здатність атома брому в 10 разів вища, ніж атома хлору. Проте вплив цього циклу на озоновий шар в даний час менший, ніж вплив інших розглянутих циклів. Це пов'язано з меншими концентраціями брому в стратосфері. Основними джерелами брому в стратосфері є органічні сполуки, що мають в своєму складі бром, які використовуються для гасіння пожеж (галони). Ці сполуки, як і фреони, стійкі в тропосфері, мають великий час життя і, потрапляючи в стратосферу, розкладаються під дією жорсткого ультрафіолетового випромінювання.
На рисунку 3.3 наведені криві, які характеризують вклад різних циклів в процес розкладання озону. Видно, що на озоновий шар впливає головним чином нітрогенний цикл.
В розглянутих вище ланцюгових процесах „активні” частинки не витрачаються. Кожна з „активних” частинок може багато разів (до 107 разів) ініціювати цикл руйнування озону, поки не буде виведена із зони з максимальним вмістом озону, де її присутність найбільш небезпечна. Наявність процесів стоку „активних” частинок, що призводять до обриву реакційного ланцюга, має велике значення з точки зору збереження озонового шару, оскільки за відсутності таких процесів весь озон в атмосфері був би зруйнований.

1 – галоїдний цикл; 2 – гідрогенний цикл; 3 – оксигенний цикл; 4 – нітрогенний цикл
Рисунок 3.3 — Вклад різних циклів в швидкість розкладання озону
Гідроксидний і гідропероксидний радикали, які є „активними” частинками гідрогенного циклу, можуть вступати у взаємодію з різними компонентами атмосферного повітря, але найвірогіднішими для стратосфери є наступні реакції:
СН4+НО 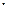 ®
® 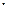 СН3 + Н2О (3.28)
СН3 + Н2О (3.28)
НО 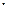 +НО2
+НО2  ® Н2О+О2 (3.29)
® Н2О+О2 (3.29)
Імовірною є і взаємодія гідроксидного радикала з монооксидом нітрогену:
НО  +NО→НNО2 (3.30)
+NО→НNО2 (3.30)
Протікання цього процесу призводить до утворення тимчасового резервуару для „активних” частинок гідрогенного і нітрогенного циклів, оскільки азотиста кислота порівняно легко розкладається з утворенням вихідних „активних” частинок. Утворення тимчасових резервуарів у вигляді азотної і азотистої кислот є однією з особливостей нітрогенного циклу. Остаточний обрив ланцюга перетворень нітрогенного циклу наступає в результаті виведення цих тимчасових резервуарів із зони з максимальною концентрацією озону в тропосферу.
Динамічні процеси, що призводять до виведення „активних” частинок в тропосферу, відіграють важливу роль також і в хлорному і в бромному циклах руйнування озону. „активні” частинки цих циклів можуть вступати і в інші реакції, утворюючи тимчасові резервуари. Особливе значення для обриву ланцюга має реакція взаємодії оксиду хлору і діоксиду нітрогену, яка призводить до утворення порівняно стійкого і інертного по відношенню до озону хлористого нитрозилу:
ClО + NO2 → ClONО2 (3.31)
Слід звернути увагу, що цей процес інтенсифікується при збільшенні концентрації ClО та NO2 в атмосфері і робить практично неможливим здійснення одночасно і нітрогенного і хлорного циклів. Проте, за певних умов, цей тимчасовий резервуар для збору «руйнівників» озонового шару може представляти серйозну небезпеку для озону, як це відбувається, наприклад, при утворенні „озонової діри” над Антарктидою.
Розглянемо тепер нижній шар атмосфери – тропосферу, яка є нерівноважною, хімічно активною системою, в якій безперервно протікають процеси, що викликають зміни концентрації домішок в атмосферному повітрі. Сполуки природного та антропогенного походження, потрапляючи в атмосферу, перетворюються у стабільні сполуки з тривалим часом життя (наприклад, СО2) або у короткоіснуючі сполуки, наприклад, кислотного характеру (оксиди Нітрогену і Сульфуру), які беруть участь у рідкофазних процесах з утворенням кислот, що видаляються з атмосфери разом з опадами. іноді продукти трансформації домішок в атмосфері, вторинні забруднювачі, становлять більшу небезпеку, ніж первинні. Прикладом може служити взаємодія оксидів Нітрогену з олефінами, алкілбензолами й альдегідами під впливом УФ-радіації, що призводить до утворення в атмосфері токсичних речовин групи пероксиацетилнітратів (ПАН):

Ця надзвичайно важлива фотохімічна реакція, до якої особливо легко вступають реакційноздатні олефіни (етилен, 2-метил-бутен-2, цис-бутен-2 та ін.), призводить до утворення в атмосфері токсичних фотооксидантів – родоначальників смогу, шкідливого для здоров'я людини і для рослин.
Час життя пероксидів зумовлений фотохімічним і термічним розпадом, тому взимку ці сполуки можуть зберігатися протягом 5-10 діб. Час життя органічних пероксінітратів в приземному шарі атмосфери складає кілька годин, в тропосфері – кілька місяців. Ці сполуки можуть переноситися на великі відстані; вони є «резервуаром» для оксидів Нітрогену та вільних радикалів, активні агенти окиснювальних процесів в атмосфері.
Атмосферу можна розглядати як величезну окиснювальну систему з високим вмістом основного окисника – кисню. Більшість газоподібних домішок, що викидаються в атмосферу, знаходяться у відновленій формі, або у вигляді оксидів з низьким ступенем окиснення (сірководень, діоксид сульфуру, метан, монооксид нітрогену). Аналіз атмосферних опадів показує, що повернені на поверхню Землі домішки представлені, головним чином, сполуками з високим ступенем окиснення (сірчана кислота, сульфати, азотна кислота, нітрати, діоксид карбону). В ході газофазних окиснювальних реакцій утворюються й органічні кислоти – переважно мурашина та оцтова.
Процеси окиснення домішок в тропосфері можуть протікати за трьома різними напрямками:
· окиснення безпосередньо у газовій фазі;
· окисненню передує абсорбція домішок частинками води, й далі процес окиснення протікає у розчині;
· окисненню передує адсорбція домішок на поверхні завислих у повітрі твердих частинок.
У цих перетвореннях крім кисню беруть участь озон О3, пероксид водню Н2О2, оксиди Нітрогену NOx, пероксиацетилнітрат (ПАН), які утворюються в атмосфері в результаті фотохімічних процесів. Але більш активними окиснювачами є вільні радикали – гідроксидний радикал НО  , гідропероксидний радикал НО2
, гідропероксидний радикал НО2  , органічні пероксидні радикали ROO
, органічні пероксидні радикали ROO  . Час життя вільних радикалів дуже малий – зазвичай декілька хвилин, їх локальні концентрації залежать від кількості реагентів та рівня сонячної радіації.
. Час життя вільних радикалів дуже малий – зазвичай декілька хвилин, їх локальні концентрації залежать від кількості реагентів та рівня сонячної радіації.
Найбільш реакційноздатний гідроксидний радикал НО  . Він може вступати в реакцію з багатьма сполуками, що наявні в атмосфері, тому у нього малий час перебування і швидкості реакцій більше, ніж у такого розповсюдженого газу, як О2. гідроксидний радикал бере участь в окисненні оксидів Нітрогену та Сульфуру в азотну та сірчану кислоти – важливі складові кислотних дощів:
. Він може вступати в реакцію з багатьма сполуками, що наявні в атмосфері, тому у нього малий час перебування і швидкості реакцій більше, ніж у такого розповсюдженого газу, як О2. гідроксидний радикал бере участь в окисненні оксидів Нітрогену та Сульфуру в азотну та сірчану кислоти – важливі складові кислотних дощів:
NO2 + HO  ® HNO3 (3.32)
® HNO3 (3.32)
SО2 + НО  ® НSО3
® НSО3  (3.33)
(3.33)
НSО3  + О2 ® НО2
+ О2 ® НО2  + SО3 (3.34)
+ SО3 (3.34)
HSО3  + НО2
+ НО2  ® SО3 + 2НО
® SО3 + 2НО  (3.35)
(3.35)
SО2 + НО2  ® SО3 + НО
® SО3 + НО  (3.36)
(3.36)
SО3 + Н2О ® Н2SО4 (3.37)
Доведено, що гази, у яких низькі швидкості реакцій з радикал НО  , мають великий час перебування в атмосфері. Так, СОS, N2O, СН4 відрізняються великим «часом життя». Хлорфторвуглеводні також практично не вступають в реакцію з гідроксидним радикалом. Подібні гази накопичуються в атмосфері і з часом переміщуються в стратосферу, де відбуваються зовсім інші хімічні процеси, вже не за участю радикалу НО
, мають великий час перебування в атмосфері. Так, СОS, N2O, СН4 відрізняються великим «часом життя». Хлорфторвуглеводні також практично не вступають в реакцію з гідроксидним радикалом. Подібні гази накопичуються в атмосфері і з часом переміщуються в стратосферу, де відбуваються зовсім інші хімічні процеси, вже не за участю радикалу НО  , а атомарного кисню О.
, а атомарного кисню О.
Активну участь в процесах окиснення в тропосфері беруть озон і ПАН, а також іон NO3-. пероксид водню і ПАН в окисненні газів в газовій фазі безпосередньої участі не беруть. Вони слугують резервуаром гідроксидних и пероксидних радикалів. В рідкофазному окисненні беруть участь пероксид водню і озон. Для більшості указаних сполук важливим є рівень освітленості, тому концентрація їх суттєво змінюється як протягом доби, так й протягом року. Аналіз вмісту озону в атмосфері великих міст показує зв'язок між швидкістю його утворення та освітленістю – ранком створюється висока концентрація оксидів Нітрогену, а всередині дня концентрація озону пропорційна концентрації оксидів Нітрогену (рис.3.4).
Вночі в атмосферних процесах важливу роль відіграє нітрат-іон, що утворюється за реакцією:
NO2 + O3® NO3- +О2 (3.38)
Концентрація його визначається і рівноважним процесом утворення N2O5:
NO  + NO2 ⇆ N2O5. (3.39)
+ NO2 ⇆ N2O5. (3.39)
нітрат-іон досить активно реагує з С-Н зв’язками альдегідів та ароматичних сполук фенольного типу з утворенням азотної кислоти:
NO  + RСНО ® НNO3 + RСO (3.40)
+ RСНО ® НNO3 + RСO (3.40)
Крім того, нітрат-іон приєднується по С=С-зв’язкам олефінів.

Рисунок 3.4 – Добовий хід концентрації компонентів фотохімічного смогу
Реакція 3.38 дуже важлива з точки зору чистоти повітряного басейну — саме в результаті цієї реакції в нічний час в містах різко знижується концентрація озону. Але в лісових масивах концентрація озону залишається високою й вночі.
При прогнозуванні концентрації кислот, в першу чергу сірчаної, необхідно враховувати процеси утворення пероксиду водню, який розчиняється у атмосферній воді й бере участь у наступних реакціях рідкофазного окиснення. пероксид водню утворюється переважно при високих концентраціях в атмосфері СО, метану та летких органічних сполук. В повітрі концентрація пероксиду водню (газоподібного) зазвичай не перевищує 4-8 млрд-1.
поглинання домішок в атмосфері опадами й усередині хмар – важливий чинник їх трансформації. Процес очищення атмосфери складається із складного ланцюгу взаємодій твердих частинок і газів із хмарним повітрям і водяними краплями. Якщо викинуті в атмосферу домішки досягають нижньої межі хмар, відбувається їх взаємодія з хмарним повітрям, яке складається з водяних крапель, крижаних кришталів, повітря і водяної пари, близької до стану насичення. Це створює особливі умови для взаємодії домішки і повітря, що відрізняються від тих, які формуються при падінні дощових крапель крізь забруднене повітря. Проте, в тому й іншому випадку переважна більшість домішок поглинається, вступає в хімічні реакції і змінює свої властивості. В основному процеси поглинання домішок хмарними елементами і дощовими краплями являються активним механізмом очищення атмосферного повітря від забруднень, при цьому природно змінюються властивості опадів, насамперед їхня кислотність. Очищення атмосфери від забруднень шляхом взаємодії домішок із хмарами й опадами відбувається у три етапи (рисунок 3.5):
- перенос домішки до місця її поглинання;
- поглинання елементами хмари й опадами, які випадають із верхньої частини хмари;
- захоплення домішки опадами в підхмарному прошарку й їх осадження з краплями дощу.
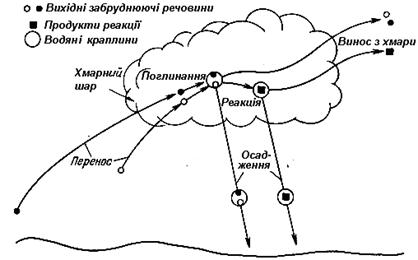
Рисунок 3.5 – Схема процесів самоочищення атмосфери за участю
| <== предыдущая лекция | | | следующая лекция ==> |
| Фізико-хімічні процеси в атмосфері | | | Хмарного шару |