
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Застосування бензену
Дата добавления: 2014-10-22; просмотров: 11568
|
|
Бензен є важливою сировиною для хімічної промисловості. Великі кількості його йдуть для одержання нітробензену, який за реакцією М. М. Зініна відновлюють в анілін:
У техніці цю реакцію проводять при дії на бензен хлоридної кислоти в присутності залізних стружок. Залізо, реагуючи з кислотою, утворює водень, який у момент виділення відновлює нітробензен. З аніліну синтезують найрізноманітніші органічні барвники і фармацевтичні препарати. Значні кількості бензену використовують для синтезу фенолу, який йде на виробництво фенолформальдегідних смол. Гексахлороциклогексан, який одержують з бензену (реакція наведена вище), під назвоюгексахлоран застосовується в сільському господарстві як один з найефективніших засобів для знищення комах. Крім того, бензен використовують для синтезу багатьох інших органічних сполук і як розчинник
18. Взаємозв’язок насичених, ненасичених і ароматичних вуглеводнів
Вивчаючи вуглеводні, можна пересвідчитися в їхній різноманітності, яка зумовлена здатністю атомів Карбону утворювати молекули лінійної, розгалуженої, циклічної будови; сполучатися між собою за допомогою простих і кратних зв’язків. А ще - утворювати гомологічні ряди та ізомери.
Порівнявши загальні формули алканів, алкенів і алкінів, можна помітити, що вони відрізняються кількістю атомів Гідрогену в молекулах. Отже, реакціями гідрування та дегідрування можна переходити від одного класу вуглеводнів до іншого.
Існує також зв’язок між насиченими, ненасиченими вуглеводнями і бензолом. Так, з метану реакцією дегідрування можна отримати ацетилен. А з нього реакцією тримеризації добути бензол.
2CH4 → C2H2 + 3H2; 3C2H2 → C6H6
Отже, за усієї різноманітності вуглеводнів між ними існує взаємозв’язок, що відбивається у взаємних перетвореннях речовин. Це відкриває величезні можливості для хімічного синтезу.
19. Природні джерела вуглеводнів
Природні джерела вуглеводнів
- Нафта — суміш рідких, газоподібних і твердих вуглеводнів (алканів, циклоалканів, аренів). Це масляниста рідина темно-брунатного або чорного кольору з характерним запахом.
- Природний газ
Склад природного газу: близько 90 % — метан, 10 % — етан, пропан, бутан, пентан.
Побіжний газ зустрічається в нафтових родовищах, нерідко утворюючи над родовищем так звану «газову шапку». У побіжному газі міститься менше метану, ніж у природному, але більше етану, пропану й інших вуглеводнів.
20. Вуглеводнева сировина та охорона довкілля
Нафта забруднює океан при аварійних ситуаціях, що виникли на танкерах, розривах морських трубопроводів, аваріях на морських бурових. Гігантські нафтові плями розливаються по поверхні води, покривають сотні кілометрів плівкою нафтопродуктів.
• У портах можна зустріти судна – збирачі нафти, розлитої по акваторії.
• Вчені розробили технологію очищення танкерів із застосуванням ефективних миючих засобів.
• На нафтопереробних підприємствах упроваджується безвідхідна технологія, вивчаються методи вилучення нафтопродуктів із води.
• Нафту збирають у спеціальні ємкості, відсмоктують, а чисту воду зливають у море.
• Суміш піску з крейдою, попадаючи на нафтову пляму, сорбує нафту. Потім ця маса осідає на дно.
ПАРНИКОВИЙ ЕФЕКТ
Атмосфера Землі розігрівається значно швидше, ніж будь-коли в минулому. Це зумовлено діяльністю людини, яка підігріває атмосферу шляхом спалювання великої кількості вугілля, нафти, газу.
За останні 120 років вміст вуглекислого газу збільшився на 17 %. У земній атмосфері вуглекислий газ діє як скло в теплиці чи парнику, але утримує тепло розігрітої Сонцем поверхні Землі. Це викликає розігрівання атмосфери, відоме під назвою парникового ефекту.
21. Насичені одноатомні спирти. Фізичні властивості
Спирти з числом атомів Карбону до 15 — рідини, інші — тверді речовини. Метанол і етанол — безбарвні рідини, з характерним запахом, добре розчинні у воді. Температура плавлення метанолу —  , етанолу —
, етанолу —  . Температура кипіння метанолу —
. Температура кипіння метанолу —  , етанолу —
, етанолу —  .
.
Біологічна дія спиртів.
Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть.
Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм.
22. Насичені одноатомні спирти. Хімічні властивості
Хімічні властивості спиртів (на прикладі етанолу).
1) Горіння:

Утворюються вуглекислий газ і вода (при достатній кількості кисню). Реакція проходить із великим виділенням теплоти.
2) Взаємодія з активними металами:

Утворюються водень і алкоголяти (у даному випадку — калій етилат).
3) Взаємодія з галогеноводнями:

4) Внутрішньомолекулярна дегідратація (за температури, що перевищує  у присутності концентрованої сульфатної кислоти):
у присутності концентрованої сульфатної кислоти):

5) Міжмолекулярна дегідратація (при надлишку спирту і температурі, що не перевищує  ):
):

23. Застосування спиртів
У харчовій промисловості широке застосування спиртів загальновідомо: основою всіх алкогольних напоїв є етанол, який виходить при зброджуванні харчової сировини - винограду, картоплі, пшениці та інших крахмало-або цукровмісних продуктів.
Крім того, етиловий спирт використовується в якості компонента (розчинника) деяких харчових і ароматичних есенцій (ароматизаторів), широко використовуються в кулінарії, при випічці кондитерських виробів, виробництві шоколаду, цукерок, напоїв, морозива, варений, желе, джемів, конфітюрів і пр.
Спирти досить широко використовуються в якості запашних речовин для складання композицій в парфюмерно-косметичної промисловості та виробництві ароматів для побутової хімії й іншої споживчої продукції.
24. Багатоатомні спирти. Фізичні властивості
Багатоатомні спирти. Фізичні властивсті.
Багатоатомні спирти містять у молекулах декілька функціональних групп – ОН.
Двохатомні СnH2n(OH)2 ; CH2OH-CH2OH етандіол етиленгліколь
Трьохатомні CnH2n-1(OH)3 ; CH2-CH-CH2 пропантриол гліцерин
Фізичні функції:
Безбарвні, сиропоподібні рідини, солодкуваті на смак, важчі за воду, добре розчинні у воді; мають високу температуру кипіння (етиленгліколь 197℃, гліцерин 290℃). Гліцерин не отруйний, етиленгліколь – сильна отрута.
25. Багатоатомні спирти. Хімічні властивості
1. Взаемодія з лужними металами з утворенням алкоголятів.
2СН2—СН—СН2+6Na>2CH2—CH—CH2+H2
| | | | | |
OH OH OH ONa ONa ONa
2. Взаемодія з НGal( заміщення групи ОН)
CH2—OH—2HCl>CH2Cl+2H2O
| |
CH2—OH CH2Cl
1,2 дихлоритан
3. Взаемодія з кислотами з утворенням естерів. Наприклад нітрування гліцерину. З карбоновими кислотами гліцерин утворює естери, жири, масла.
СН2ОН CH2O—NO2
| |
СНОН +3HONO2> CHO—NO2+3H2O
| |
СH2OH CH2O—NO2
тринітрогліцерин
4. Взаемодія з деякими гідроксидами(на відміну від одноатомних спиртів)
CH2OH CH2ONa
| +2NaOH> | +H2O
CH2—OH CH2ONa
26. Феноли. Фізичні властивості
Феноли-ароматичні сполуки,до складу молекул яких входять гідроксильні групи,зв`язані з ароматичним ядром.
Фізичні властивості.
Тверда,кристалічна речовина (t пл. 42 C).Червоніє на повітрі через окиснення . За кімнатної температури погано розчинний у воді ,при 60 С у будь-яких співвідношеннях,отруйний.
27. Феноли. Хімічні властивості
Обумолвені ОН:
Зростає кислотність групи ОН.Фенол-слабша кислота за Н2СО3 і H2S, але сильніша за алканоли.
1)+акт ме з утворенням фенолятів 2C6H5OH+2NA=2C6H5ONA+H2
2)взаємод з лугами C6H5OH+NAOH=C6H5ONA+H2O феноляти розкл-ся слабкими кислотами
3)якісна реакція на фенол 3C6H5OH+FECL3=(C6H5O)3FE+3HCL(фіол р-н ферум(3)феноляту)
Обумолвені бензольним ядром
Внасл зрост електронної густини у кільці полегшується атака кільця частинками, що мають дефіцит електронів.Реакц електрофільного зміщення.
1. 
28. Застосування фенолів
Фенол було вперше виділено з кам'яновугільної смоли в першій половині XIX ст. Його застосування тісно пов'язане з розвитком синтетичної органічної хімії. Фенол є вихідною речовиною для виробництва барвників, лікувальних препаратів, пластичних мас, вибухових речовин.
Фенол має антисептичні властивості, які були виявлені ще у другій половині XIX ст. Вони зумовлюють використання його розчину (5%-го) для знезаражування приміщень, хірургічних інструментів, його добавляють до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю.
Разом з тим це токсична речовина, що може спричинити опіки шкіри. Оскільки фенол є продуктом коксохімічної промисловості, то вкупі з іншими промисловими викидами він потрапляє у стічні води, тим самим забруднює навколишнє середовище.
29. Порівняти властивості етанолу і фенолу
Етано́л (С2Н5ОН) — це сильна психоактивна речовина і один з найстаріших наркотиків, протоплазматичнаотрута; головна діюча складова алкогольних напоїв, які зазвичай виготовляються збродженням здатних до ферментації вуглеводів. Етиловий спирт — безбарвна рідина із слабким «алкогольним» запахом. Густина його 0,789 г/см3. Температура кипіння 78,3°С. З водою змішується в будь-яких пропорціях. Етиловий спирт є гарним розчинником для багатьох органічних, а також неорганічних речовин
Феноли(C6H5OH) – органічні сполуки в молекулах, яких гідроксильні групи сполучені безпосередньо з бензольним кільцем.Розрізняють одноатомні(фенол) та багатоатомні(гідрохін, піронатехін, резорцин) феноли. Фенол утворює безбарвні призматичні кристали, що розовіють при зберіганні на повітрі. При температурі = 65,3 фенол змішується з водою, нижче 65,3 у воді утворюється два шари: фенолова і водна.Температура плавлення = 40,5, температура кипіння 181,84, критична – 421,1.
30. Альдегіди. Фізичні і хімічні властивості
Альдегіди(алканалі)-це органічні сполуки, молекули яких містять функціональну групу атомів 
(альдегідна, або формільна), зв’язану з вуглеводневим радикалом.

Фіз власт:
Метаналь-газ, інші нижчі альдегіди-рідина, вищі-тверді. Мурашиний та оцтовий альдегіди мають специфічний запах, добре розчинні у воді. Водний 40% розчин формальдегіду наз. формалін.
Хім власт:
Реакція окиснення 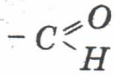 до кислот
до кислот 
1)Амоніачним розчином аргентум оксиду – якісна реакція на альдегіди

2)Купрум(2) гідроксидом

3)Повне окиснення

Реакція приєднання
4)Відновлення воднем до спиртів

5)Реакція полімеризації формальдегіду

6)Реакція поліконденсації формальдегіду з фенолом

№31. Альдегіди. Застосування.
Альдегіди - клас органічних сполук, що містять карбонільну групу (С = О) з одним алкільним або арільним заступником. Аліфатичні та ароматичні органічні хімічні сполуки, що містять альдегідну групу НС=О.
Застосування. Оцтовий альдегід застосовують головним чином для добування оцтової кислоти, а також у деяких органічних синтезах. Формалін використовують у сільському господарстві для протруювання насіння з метою знищення личинок шкідників, його застосовують також для дезинфекції приміщень, хірургічних інструментів. Взаємодією формальдегіду з аміаком добувають відому лікарську речовину уротропін.
№32. Поняття про карбонові кислоти.
Карбонові кислоти - клас органічних сполук, молекули яких містять одну або кілька функціональних карбоксильних груп -COOH. Кислі властивості пояснюються тим, що дана група може порівняно легко відщеплює протон. За рідкісними винятками карбонові кислоти є слабкими. За кількістю цих груп розрізняють одноосновні (бензойна, оцтова кислота), двоосновні (щавелева, фталева, азелаїнова кислота) та багатоосновні (лимонна) карбонові кислоти. Карбонові кислоти є слабкими кислотами, тому їх солі зазнають гідролізу. Ароматичні карбонові кислоти сильніші за насичені аліфатичні.
№33. Фізичні властивості карбонових кислот.
Нижчі карбонові кислоти - рідини з гострим запахом, добре розчинні у воді. З підвищенням відносної молекулярної маси розчинність кислот у воді і їх щільність зменшуються, а температура кипіння підвищується. Вищі кислоти, починаючи з пеларгонової - тверді речовини, без запаху, нерозчинні у воді. Нижчі карбонові кислоти у безводному вигляді та у вигляді концентрованих розчинів дратують шкіру і викликають опіки, особливо мурашина кислота і оцтова кислота.
№34. Хімічні властивості карбонових кислот.
іВластивості кислот .
Дисоціація СН3СООН  СН3СООНˉ + Н+; лакмус червоніє.
СН3СООНˉ + Н+; лакмус червоніє.
1) Взаємодія з металами (до Н), оксидами металів, основами:
їСН3СООН + Zn (CH3COO)2Zn + Н2↑ ; 2СН3СООН + СаО ⟶ (СН3СОО)2Са + Н20
1СH  СООН + Са(ОН)2 ⟶ (СН3СОО)2Са + 2H20
СООН + Са(ОН)2 ⟶ (СН3СОО)2Са + 2H20
Взаємодія з солями більш слабких і летких кислот:
UCOOH > Н3Р04; СН3СООН > Н2С03 СН3СООН + СаС03 ⟶ (СН3СОО)2Са + Н20 + С02↑
CH3 - C + CH3 OH CH3C CH3 + H2O
Зміщення Н в а- позиції R C C 
CH3COOH + CI 2 CH2CICOOH+HCI
Хлороцтова кислота
№35. Застосування карбонових кислот.
Солі карбонових кислот і лужних металів застосовують як мила, емульгатори, мастила; солі важких металів - сикативи, інсектициди та фунгіциди, каталізатори. Ефіри кислот - харчові добавки, розчинники; моно-і діефіри гликолей і полигликолей пластифікатори, компоненти лаків та алкідних смол; ефіри целюлози - компоненти лаків і пластмаси. Аміди кислот емульгатори і флотоагенти.
№36. Добування карбонових кислот.
Окислення спиртів: RCH2OH + [O] → RCOOH
Окислення альдегідів: RCHO +[O] → RCOOH
Гідроліз трігалогеналканов: RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O
Карбоксилювання металоорганічних сполукRCH2Li + CO2 → RCOOLi; 2RCH2MgCl + 2CO2 → (RCOO)2Mg
Гідроліз складних ефірів: R¹ - COO - R² - KON → R¹ - COOK - R² - OH
№37. Порівняти неорганічні і органічні (карбонових) кислот.
| Властивості | Органічні сполуки | Неорганічні сполуки |
| Переважаючий тип хімічного зв’язку | Ковалентний слабкополярний | Йонний, ковалентний сильнополярний |
| Температура плавлення та кипіння | У більшості випадків низькі, до 3500С | Високі, зазвичай понад 6000С |
| Стійкість за високих температур | Зазвичай розкладаються на простіші речовини за температури близько 300-4500С | Більшість сполук стійкі до декількох тисяч градусів |
| Розчинність | Добре розчиняється у деяких органічних розчинах, рідко у воді | Розчинні у воді |
| Електричні властивості | Майже всі сполуки – діелектрики та їхні розчини - неелектроліти | Багато речовин добре проводять електричний струм, багато з них у розчиненому або розплавленому стані є електролітами |
| Швидкість перебігу обмінних реакцій | Повільна | Швидка |
| Поширеність | У живій природі (флора і фауна) | У неживій природі (атмосфера, гідросфера, літосфера) |
Види ізомерії:
(Органічні сполуки)
| <== предыдущая лекция | | | следующая лекция ==> |
| Застосування ацетилену | | | Геометрична |