
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Геометрична
Дата добавления: 2014-10-22; просмотров: 1588
|
|
Порядок з'єднання атомів однаковий, але ізомери відрізняються геометрією.
№38. Поняття про естери.
Есте́ри (також Складні́ ефі́ри) — клас органічних сполук. Похідні карбонових або мінеральних кислот. За своєю будовою естери на перший погляд схожі з солями. Насправді ж схожість тут лише формальна. Зв'язок між вуглеводневим радикалом, тобто залишком, який виходить, якщо відняти від молекули вуглеводню один атом водню, і рештою частини молекули в естері ковалентний, а не іонний, як у солях. Естери (складні етери), на відміну від більшості солей, нерозчинні у воді, але розчиняються в органічних розчинниках. Розчини їх не проводять електричного струму.
№39. Фізичні властивості естерів.
Легкі рідини(відсутність водневих зв`язків), малорозчинні у воді, добре розчинні в органічних розчинниках. Багато складних ефірів карбонових кислот мають характерні фруктові або квіткові запахи, через що їх використовують як штучні ароматизатори. Наприклад:
Бутилацетат має грушевий аромат
Метиловий ефір масляної кислоти — яблуневий
Етиловий ефір масляної кислоти — ананасовий або «абрикосовий»
Етиловий ефір ізовалер'янової кислоти — малиновий
Етиловий ефір валер'янової кислоти — виноградний
№40. Хімічні властивості естерів.
1)Гідроліз(омилення)-зворотна щодо реакції етерифікації. Реакція каталізується протонами Н+ та гідроксид іонами ОН-. В присутності лугів реакц необоротна.
CH3-C(=O)-O-C2H5+HOH=CH3-c(=O)-OH+C2H5OH(етанол)
2)+луг
CH3-C(=O)-O-C2H5+NAOH=CH3-C(=O)-ONa+C2H5OH
3)гідрування
C2h5-C(=O)-O-C2H5+2H2=C3H7+C2H5OH(етанол)
№41. Поняття про жири.
Жири - це складні ефіри трьохатомного спирту гліцерину і карбонових кислот. На позначення жирів використовуються також слова «олії», «масла» і «ліпіди». Слово «олії», як правило, використовується для позначення жирів, які є рідкими при кімнатній температурі, у той час як слово «жири» зазвичай використовується для позначення жирів, які є твердими речовинами при нормальній кімнатній температурі.
«Ліпіди» використовується для позначення рідких і твердих жирів, а також інших пов'язаних з жиром речовин, як правило, в медичному або біохімічному контексті. Слова «олії» і «масло» також використовуються для будь-яких речовин, незалежно від їх хімічної структури, що не змішуються з водою і жирні на дотик: ефірні олії, терпентинова олія, мінеральні олії, солярове масло, синтетичні масла.
№42.Фізичні властивості жирів.
Жири нерозчинні у воді, добре розчиняються в органічних розчинниках, але зазвичай погано розчиняються в спирті. При обробці перегрітою парою, мінеральними кислотами або лугом жири піддаються гідролізу (омилення) з утворенням гліцерину і жирних кислот або їх солей утворюючи мила. При сильному збовтуванні з водою утворюють емульсії. Прикладом стійкої емульсії жири у воді є молоко. Емульгування жирів у кишечнику (необхідна умова їх всмоктування) здійснюється солями жовчних кислот.
№43. Хімічні властивості жирів.
Гідроліз водню
CH2-O-CO-R CH2-OH
↓
↓ t,p або k
CH-O-CO-R +3H20 = CH-OH+3R-COOH
↓ КИСЛОТА
↓
CH2-O-CO-R CH2-OH : так добувають гліцерині кислоти
Тригліцерид гліцерин
Лужний гідроліз(омилення)
CH2-O-CO-C17H35 CH2-OH
↓
↓
CH-O-CO-C17H35 +3NaOH → CH-OH + 3C17H35COONa
↓ ↓ натрий стеаарат або мило
CH2-O-CO-C17H35 CH2-OH
Тристеарин : так добувають мило
Гідрування рослинних жирів-перетворення у тверді(маргарин)
CH2-O-CO-C17H33 CH2-O-CO-C17H35
↓ t,ni ↓
CH-O-CO-C17H33 + 3H2 → CH2-O-CO-C17H35
↓ ↓
CH2-O-CO-C17H33 CH2-O-CO-C17H35
Триолеїн тристеарин
№44. Застосування жирів.
Жири - важливий продукт харчування людини. Жири становлять головний компонент таких продуктів харчування, як вершкове масло, рослинні олії, маргарин, смалець. Багато жирів міститься у свинячому салі та у сирі. Підшкірна основа виконує низку важливих функцій в організмі: теплоізоляційну (захищає глибоко розміщені тканини від надмірного впливу холоду і тепла), амортизаційну (охороняє кістки, тканини і внутрішні органи від поштовхів і ударів), естетичну (надає формам тіла ніжну округлість). Безпосередньо з лікарською метою на жирах готують мазі, емульсії, пасти, які сприяють поглинанню активних речовин організмом, пом'якшують і продовжують їхню дію.
№45. Застосування естерів.
Етилформіат та етилацетат використовуються як розчинники целюлозних лаків. Складні ефіри на основі нижчих спиртів і кислот використовують у харчовій промисловості при створенні фруктових есенцій, а на основі ароматичних спиртів — у парфумерній промисловості. Воски входять до складу косметичних кремів і лікарських мазей. Тваринні жири і олії являють собою сировину для одержання вищих карбонових кислот, миючих засобів і гліцерину. На основі рослинних олій виготовляють оліфи, що складають основу олійних фарб.
№46. Мило. Застосування.
Мило - розчиняється у воді миюча маса (шматок або густа рідина), одержувана взаємодією жирів і лугів, використовуване або як косметичний засіб - для очищення і догляду за шкірою ( туалетне мило); або як засіб побутової хімії - миючий засіб ( господарське мило).
№47. Вуглеводи. Їх класифікація.
Вуглеводи(сахариди) –це сполуки Карбону, Гідрогену і Оксигену, в яких співвідношення між Гідрогеном і Оксигеном таке, як у води( Сn(H2O) m). Містять декілька гідроксогруп. Вуглеводи є складовою частиною клітин усіх живих організмів.Вуглеводи поділяються на
полісахариди(C6H10O5) – крохмаль, целюлоза.-це вуглеводи, які не мають солодкого смаку, і майже не розчинні в воді. Вони представляють собою складні високомолекулярні сполуки, які під каталітичним впливом кислот чи ферментів піддаються гідролізу.
Дисахариди(С12Н22О11)-сахароза. вуглеводи, які при нагріванні з водою в присутності мінеральних кислот чи під дією ферментів піддаються гідролізу, розкладаються на дві молекули моносахаридів.
Моносахариди (гексози (глюкоза і фруктоза – С6Н12О6) і пентози (рибоза(С5Н10О5) і дезоксирибоза(С5Н10О4). прості вуглеводи, вони не піддаються гідролізу — не розщеплюються водою на простіші вуглеводи.
№48. Значення вуглеводів у життєдіяльності організмів.
Вуглеводи - обширний найпоширеніший на Землі клас органічних сполук, що входять до складу всіх організмів і необхідних для життєдіяльності людини і тварин, рослин і мікроорганізмів. Вуглеводи є первинними продуктами фото - синтезу, у кругообігу вуглецю вони служать своєрідним мостом між неорганічними та органічними сполуками. Вуглеводи і їх похідні у всіх живих клітинах виконують роль пластичного і структурного матеріалу, постачальника енергії. Ще одна важлива роль вуглеводів в організмі людини і тварин пов’язана з тим що вуглеводи на відміну від білків можуть розщеплюватися як за участю кисню, так і без нього. Це дуже важливо для організмів які мешкають в умовах браку кисню. В організмі і клітці вуглеводи мають здатність накопичуватися у вигляді крохмалю у рослин і глікогену у тварин.
№49. Добування штучних волокон.
волокнисті матеріали мають рослинне походження й складаються із целюлози, наприклад льон, бавовна; інші — тваринне походження й складаються з білків, наприклад вовна, шовк.
останнім часом потреби населення в тканинах і техніці суттєво зросли, волокнистих матеріалів не вистачає. Саме тому волокна стали добувати хімічним способом.
два хімічні способи отрімання волокон. Оскільки волокна характеризуються впорядкованим, орієнтованим вздовж осі волокна, розташуванням лінійних макромолекул, то можна взяти природний полімер неупорядкованої структури й шляхом тієї чи іншої обробки переробити в ньому розташування макромолекул, укласти їх в одному напрямку.
Можливий також інший спосіб — добути полімер синтетичним шляхом і потім здійснити в ньому потрібне укладання молекул.
У промисловості добувають волокна і тим, і іншим способом. Волокна, добуті переробкою природних полімерних матеріалів, називають штучними, а добуті із синтезованих полімерів — синтетичними.
У ролі вихідного природного полімеру для добування штучних волокон беруть целюлозу50. Нітрогеновмісні органічні сполуки
До цього класу органічних речовин відносять нітросполуки R-NO2,а міни , амінокислоти, H2N-R-COOH2,білки.+Аміни +Аміноксилоти +Синтетично волокно +Білки
Амінокислоти — це органічні сполуки, що містять дві функціональні групи: аміногрупу  — і карбоксильну групу .
— і карбоксильну групу .
Хімічні властивості амінокислот. Хімічні властивості амінокислот визначаються функціональними групами, що входять до їхнього складу. Карбоксильна група — носій кислотних властивостей, а аміногрупа — основних, тому амінокислоти належать до амфотерних сполук. Цим зумовлена властивість молекул амінокислот реагувати одна з одною. У реакцію вступають карбоксильна група однієї амінокислоти й аміногрупа іншої.
№51. Поняття про амінокислоти.
Амінокислоти — це органічні сполуки, що містять дві функціональні групи: аміногрупу — NH2 і карбоксильну групу — COOH. Назви амінокислот походять від назв відповідних кислот із додаванням префікса аміно-: амінооцтова, аміномасляна тощо. Також застосовуються тривіальні назви, наприклад амінооцтова кислота називається гліцином.
№52. Фізичні властивості амінокислот.
Фізичні властивості амінокислот.Амінокислоти – безбарвні тверді кристалічні речовини, переважно добре розчинні у воді і практично нерозчинні в органічних розчинниках. Вони мають високі температури плавлення, багато з них солодкі на смак.№53. Хімічні властивості амінокислот.
Хімічні властивості амінокислот визначаються функціональними групами, що входять до їхнього складу. Карбоксильна група — носій кислотних властивостей, а аміногрупа — основних, тому амінокислоти належать до амфотерних сполук. Цим зумовлена властивість молекул амінокислот реагувати одна з одною. У реакцію вступають карбоксильна група однієї амінокислоти й аміногрупа іншої. При цьому утворюється молекула води, зв’язок, який виник, називається пептидним, а сполука, що утворилася, — ди-, три-, …, поліпептидом.
№54. Поняття про білки. Склад і будова молекул.
Білки- біополімери, утворені залишками а-амінокислот, які з’єднані пептидним зв’язком.
Склад молекул білків
Усі білки містять С, H, O, N. Більшість білків містять ще і Fe, до білка щитоподібної залози-I.
Будова молекул білків
Білкова молекула- поліпептид, містить 2- 100 амінокислотних залишків(близько 20 а-амінокислот).
1.Послідовність амінокислот- первинна структура.
2.Утворені спіралі – вторинна.
3.Складання ділянок спіралі у клубки (глобули) – третинна.
4.Розміщення у просторі кількох глобул-четвертинна.
№55. Фізичні і хімічні властивості білків.
1.Горіння – з характерним запахом «паленого пір'я»
2.Денатурація-руйнування вторинної і третинної структур( втрата біологічної функції).
3.Гідроліз- розщеплення білкової молекули на амінокислоти( прискорюються лугами, кислотами, ферментами).
C(=0)-N(-Н)+HOH=……-C(=О)-OH-NH2
4.Кольорові реакції- якісні на білок:
- біуретова: білок+луг+CuSO4= жовтий колір;
- ксантопротеїнова: білок + HNO3= жовтий колір.
Добування
1)Гідролізом білків
2)З карбонових кислот
CH3COOH+Cl2=CH2-COOH+HCl
CH2-COOH+NH3=CH2-COOH+HCl
№56. Значення хімії у створенні нових матеріалів.
У промисловості широко використовуються різні матеріали. Хімія робить суттєвий внесок у створення різноманітних матеріалів: металічних і неметалічних. Серед металічних матеріалів найчастіше використовуються сплави на основі заліза - чавун і сталь, на основі міді - латунь і бронза, на основі алюмінію, магнію, нікелю, ніобію, титану, танталу, цирконію та інших металів. З металічних сплавів виготовляються теплообмінники, ємкості, мішалки, трубопроводи, контактні апарати, колони та інші апарати.
№57. Завдання хімії у розв’язанні сировинної проблеми.
1) розвідування й застосування дешевої сировини, нових видів альтернативних сировинних матеріалів;
2) комплексне використання сировини;
3) розробка нових ефективних методів рециркуляції, тобто багаторазового використання різних видів сировини, наприклад металів;
4) використання відходів як сировини;
5) Подовження строків експлуатації металів;
6) Заміна традиційних матеріалів новими;
7) “Зелена” хімія. За допомогою біотехнології для хімічного синтезу використовувати органічні речовини рослин (найперспективніша - кукурудза) та побутові відходи, що містять целюлозу.
№58. Значення хімії у розв’язанні енергетичних проблем.
Забезпеченість енергією є найважливішою умовою соціально-економічного розвитку будь-якої країни, її промисловості, транспорту, сільського господарства, сфер культури і побуту. Особливо багато енергії споживає хімічна промисловість. Енергія витрачається на здійснення ендотермічних процесів, на транспортування матеріалів, кришіння та здрібнення твердих речовин, фільтрування, стиснення газів тощо.
Джерелами енергії найчастіше є традиційні невідновні природні ресурси — вугілля, нафта, природний газ, торф, сланці. У різних країнах енергетичну проблему розв'язують по-різному, проте всюди в її розв'язання значний внесок робить хімія. У різних країнах енергетичну проблему розв'язують по-різному, проте всюди в її розв'язання значний внесок робить хімія. Дуже перспективною видається воднева енергетика, що ґрунтується на спалюванні водню, під час якого шкідливі викиди не виникають. Проте для її розвитку потрібно розв'язати низку завдань, поєднаних зі зниженням собівартості водню, створенням надійних засобів його зберігання та транспортування тощо.
№59. Хімія у повсякденному житті.
У побуті ми практично щоденно зустрічаємося з продуктами хімічної промисловості та з хімічними процесами. Це прання білизни, миття посуду, доглядання за підлогою та меблями застосування клею, а також готування їжі, умивання з милом, догляд за шкірою обличчя та інша особиста гігієна тощо.
Для чищення посуду, раковин у мийні засоби часто вводять тверді інертні речовини — абразиви, які полегшують механічне руйнування твердих забруднень. Хімічна промисловість випускає великий асортимент них клеїв. Міцність зчеплення клею відносно склеюваних поверхонь визначається силами міжмолекулярної взаємодії (електростатичними силами) або хімічними силами, які ведуть до утворення хімічного зв'язку. До групи найкращих смол, клеїв і лаків належать епоксидні. Їм властива висока липкість до скла, порцеляни, металів, пластмас, дерева та висока межа міцності.
№60. Основні джерела забруднення довкілля.
За останні роки в Україні в атмосферу викинуто більш як 100 млн. т шкідливих речовин. Підприємства металургії та енергетики — головні забруднювачі повітря — щорічно дають відповідно 35 і 32 % всіх забруднень від стаціонарних джерел. Основні забруднювачі довкілля важкими металами, особливо арсеном і свинцем, а також сірчаною та азотною кислотами — підприємства кольорової металургії. До основних забруднювачів довкілля належить також хімічна промисловість, об’єкти якої викидають у повітря сірчаний ангідрид, оксиди азоту, вуглеводні та інші шкідливі речовини. До екологічно шкідливих належить і цементна промисловість. Саме на підприємствах цієї галузі найгірше здійснюються природоохоронні заходи: наприклад, концентрація пилу в їхніх викидах у 5—10 разів більша за ГДК. Із забрудненими стічними водами в річки щороку скидаються тисячі тонн органічних речовин, суспензій, солей, інших шкідливих сполук. Великої шкоди рельєфу, земельним ресурсам, ґрунтовим водам завдає гірничодобувна промисловість. Сильно забруднюють довкілля об’єкти енергетики, передусім ТЕЦ і ГРЕС. Поглинаючи величезну кількість нафтопродуктів, газу й вугілля, вони викидають в атмосферу мільйони кубометрів шкідливих газів, аерозолей і сажі, захаращують сотні гектарів землі шлаками й золою.
61 Дано :
V=40 л
M(СH3Cl)=30.3г
Wвих=40%
Знайти:w(CH4)
Розвязання:
CH4+Cl2=CH3Cl+4Cl
Wвих=30.3/40*100=75.75
22.4*75.75/50.5=33.6
33.6*100/40=84%
Відповідь:84%
62Дано:
W(C)=85.71%
W(H)=14.29%
D(H2)=42
Знайти: CxHy=?
Розвязання:
D(H2)=14/2
M=84
C=85.71/12/14.29/1=7.1425/14.29=2
M(CH2)=12+2=14
N=84/14=6
CH2*6=C6H12
Відповідь: C6H12
64a)CH3-CH-CH2-CH3
\
CH3
б)CH3-CH=CH-CH3
\ \
C2H5 CH3
65C3H8 пропан, С10H22 декан, С8H18 октан,С9H20 нонан
66Дано :
V(C2H2)=33.6 л (н.у)
Р(С6H6)=0.8г,см3
Знайти:V(C6H6)=?
Розвязання:
3С2H2=>C6H6/78
33.6/22.4*3/x2/78
X=39г
V=39/0.8=48.75л
Відповідь: 48.75л
67.2CH4=HC(потрійний звязок)CH+3H2
3HC(потр звязок)CH=C6H6
1)CH4->C2H2->C6H6->C6H5Cl
2СН4 ==> C2H2 + 3H2 (1500 градусов
С6Н6 + Cl2 ==> C6H5Cl + HCl (катализатор AlCl3)
69 1)2СН4 => C2H2 + 3H2
2)3С2Н2=>C6H6
3)C6H6+HNO2=>C6H5NO+H2O
701)CaCO3=>CaO+CO2
2)CaO+3C=>CaC2+CO
3)CaC2+2H2O=Ca(OH)2+C2H2
4)3С2Н2=>C6H6 (500 градусов)
71 С2Н4 >А>В>С2Н5>О>С2Н5
2. С2Н4>2С+Н2
3. С2Н4+СІ2>С2Н3СІ+НСІ
4. С2Н3СІ+Н2>С2Н5+СІ2
5. С2Н5>2С+Н2
6. 2С2Н5+Вr2>2С2Н3Br
72Дано:
С2H5OH=9.2г(н.у.)
Розвязання:
С2H5OH(9.2) =>CH4(22.4)+H2O
9.2*22.4/46=4.48л
Відповідь: 4.48л
731)C2H6 + Cl2 => C2H5Cl + HCl
2)C2H5Cl +KOH=>C2H4+ KCl+H2O
3)C2H4+H2O=> C2H5OH
4) C2H5OH => C2H5 + H2O
741)C2H5OH=>C2H4+H2O
2) C2H4HCl=>C2H5Cl
751)CH4=>3C2H2+H2(t)
2)2C2H2=>2C2H4+H2
3)С2H4+ H2O =C2H5OH
761)CH4=>(t)3C2H2+..
2)3C2H=>C6H6
3) C6H6+Cl=>C6H5+HCl
4)C6H5Cl=H2O=> C6H5OH+HCl
5) C6H5OH+Na=>C6H5ONa+H2
77Дано:
V=3л
р=1,06г\мл
W(альд)=20%
Знайти:
М(розч)?
Розвязання:
Mr=3*1.06=3.18г
V=3000мл
М=20*3180/100=362г
Відповідь: 362г
1) 2метилбутанова кислота
2)
79Дано:
P=1.07 г\мл
V=200мл
P=1.007г\мл
W(CH3COOH)=80%
Розвязання:
M=vp=200*1.007=201.4г
M(80%)=201.4*3/40=15.150г
v=15.105/1.07=14.117мл
201.4-15.105=186.295
Відповідь:186,295г
80.
2СН4(t)=3H2+C2H2
C2H2+H2O=C2H4O
CH3CHO+Ag2O=CH3COOH+2Ag
CH3COOH+NaOH=CH3COONa+H2O
811)СH4+O2=>H-C=O +H2O
\
H
2) H-C=O +H2=CH3OH
\
H
3) CH3OH+ CHl=CH3Cl+H2O
4)2CH3Cl+Na=NaCl+C2H6
5) C2H6= (t)C2H4+H2=C2H4+H2O=C2H5OH
6) C2H5OH+[O]=CH3=O+H2O
\
H
821)C2H6+Br2=>C2H5Br+HBr
2) C2H5Br+H2O=>C2H6OH+HBr
3) C2H6OH+O2=>CH3-COOH+H2O
4) CH3-COOH+C2H5OH=>CH3COOC2H
83. Три стеарин (C17H35COO)3C3H5 -> спирт -> алкоголят купрума (II).
1) 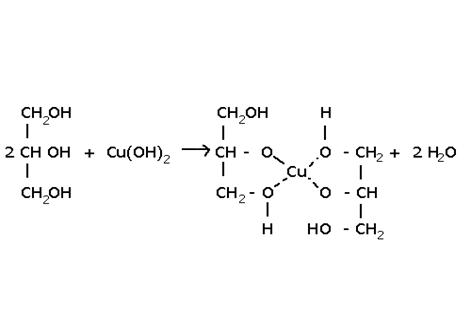 (С17Н35СОО)3С3Н5 + 3NaOH = 3C17H35COONa + CH2(OH)-CH(OH)-CH2(OH)
(С17Н35СОО)3С3Н5 + 3NaOH = 3C17H35COONa + CH2(OH)-CH(OH)-CH2(OH)
глицерин – спирт
84Дано:
W(C6H10O6)=20%
Мкарт.=1620кг
Wвих.=75%
Знайти:
М(C6H12O6)=?
Розвязання:
Мкр.=20*1620/100=324
324/160:х/180=>324*180/162=360г
Відповідь: 360г
851)C6H12O6=>2C6H5OH+2CO6
2)C2H5OH+HCl=>C2H5Cl+H2O
87Дано:
СаC2=200л
Wдом=5%
Знайти:V(C2H2)-?
Розвязання:
200-100%
x-95%
x=200*95/100=190
V=190*22.4/64=66.5л
Відповідь: 66.5л
881)С2H4+HBr =>C2H5Br
2)С2H5Br +H2O =>C2H5OH
3)C2H5OH+O2=>CH3COOH
4)CH3COOH+Cl2=>CH2ClCOOH
C2H2=>C2H3-OH=>CH3COOH=>CH2COOH-Cl=>CH2-COOH
NH2
1) C2H2+H2O=> C2H3-OH
2) C2H3-OH+[O]=> CH3COOH
3) CH3COOH+Cl=> CH2COOH-Cl
4) CH2COOH-Cl+NH3=> CH2-COOH
NH2
90СH4=>C2H2=>C6H6=>C6H5=>C6H5OH
1) СH4=>(t)C2H2+H2
2) 3C2H2=>C6H6
3) C6H6+Cl2=>C6H5Cl+HCl
4) C6H5CL+H2O=>C6H5OH+HCl
| <== предыдущая лекция | | | следующая лекция ==> |
| Застосування бензену | | | Броуновское движение частиц в растворе |