Слабые электролиты. Константа и степень диссоциации
Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. В их растворах устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации – ионами. Например, в водном растворе уксусной кислоты устанавливается равновесие
Константа этого равновесия (константа диссоциации) связана с концентрациями соответствующих частиц соотношением:
Константа диссоциации зависит от природы электролита и растворителя и от температуры (увеличивается с ростом температуры), но не зависит от концентраций ионов и молекул. Степенью диссоциации ( a ) электролита называется доля его молекул, подвергшихся диссоциации, т. е. отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе. Степень диссоциации увеличивается с ростом температуры и уменьшается с увеличением концентрации электролита в растворе. Константа и степень диссоциации связаны соотношением (закон разбавления Оствальда):
где с – молярная концентрация электролита, моль/л. Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1–a»1. Тогда выражение закона разбавления упрощается: Кдиссоц. = a2´ с, откуда: Последнее соотношение показывает, что при разбавлении раствора (т. е. при уменьшении концентрации электролита с) степень диссоциации электролита возрастает. При введении в раствор слабого электролита одноименных ионов (т. е. ионов, одинаковых с одним из ионов, образующихся при диссоциации электролита) равновесие диссоциации нарушается и смещается в направлении образования недиссоциированных молекул, так что степень диссоциации электролита уменьшается. Так, прибавление к раствору уксусной кислоты ее соли (например, ацетата натрия) приведет к повышению концентрации ионов CH3COO– и, в соответствии с принципом Ле Шателье, равновесие диссоциации CH3COOH Û CH3COO– + H+ сместится влево. Константа диссоциации при этом не меняется, так как она не зависит от концентраций ионов. Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества (молекул и ионов) в растворе возрастает по сравнению с раствором неэлектролита той же молярной концентрации. Поэтому свойства, зависящие от общего числа находящихся в растворе частиц растворенного вещества (коллигативные свойства), такие, как осмотическое давление, понижение давления пара, повышение температуры кипения, понижение температуры замерзания, проявляются в растворах электролитов в большей степени, чем в равных по концентрации растворах неэлектролитов. Если в результате диссоциации общее число частиц в растворе электролита возросло в i раз по сравнению с числом его молекул, то это должно быть учтено при расчете осмотического давления и других коллигативных свойств. Изотонический коэффициент i связан со степенью диссоциации электролита a соотношением:
Здесь k – число ионов, на которые распадается при диссоциации молекула электролита (для KCl k = 2, для ВаСl2 и Na2SO4 k = 3 и т. д.). Таким образом, найдя по опытным величинам Δ р, Δ tкрист., Δ tкип., Росм. значение изотонического коэффициента i, можно вычислить степень диссоциации электролита в данном растворе. При этом следует иметь в виду, что в случае сильных электролитов найденное таким способом значение a выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие кажущейся степени диссоциации от единицы связано с межионными взаимодействиями в растворе. В растворах сильных электролитов, для описания состояния ионов в растворе, пользуются наряду с концентрацией ионов, их активностью, то есть условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией с в растворе соотношением:
|

 или
или .
.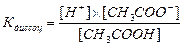 .
. ,
, .
. или
или  .
. , γ – коэффициент активности (безразмерная величина).
, γ – коэффициент активности (безразмерная величина).


