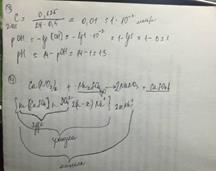
Билет№41.КИНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ - устойчивость коллоидных систем к оседанию. Определяется способностью частиц к броуновскому движению. В качестве меры кинетической устойчивости принимается гипсометрическая высота, т.е. высота, на которой частичная концентрация уменьшается в 2 раза. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ - способность системы к сохранению постоянной дисперсности. Для коллоидных систем специфична агрегативная неустойчивость, так как лиофобные системы обладают большим запасом свободной энергии на границе раздела фаз, поэтому всегда возможен процесс агрегации (слипания) частиц и уменьшение общей поверхности дисперсной фазы. Для придания агрегативной устойчивости требуется введение стабилизатора. СТАБИЛИЗАЦИЯ - процесс создания защитных ионных или молекулярных слоев на межфазных границах, которые придают системе агрегативную устойчивость. СТАБИЛИЗИРУЮЩАЯ СПОСОБНОСТЬ - способность растворов вещества (обычно ПАВ) сообщать устойчивость дисперсной системе против агрегации и седиментации путем образования на поверхности частиц дисперсной фазы защитного адсорбционного слоя. Такие вещества называют стабилизаторами. Коллоидные системы могут быть газообразными, жидкими и твердыми. Наиболее распространены и изучены жидкие (лиозоли). Коллоидные растворы для краткости обычно называют золями. В зависимости от природы растворителя - дисперсионной среды, т.е. воды, спирта или эфира, лиозоли называют соответственно гидрозоли, алкозоли или этерозоли. По интенсивности взаимодействия частиц дисперсной фазы и дисперсионной среды золи делят на 2 группы: лиофильные - интенсивное взаимодействие, в результате которого образуются развитые сольватные слои, например, золь протоплазмы, крови, лимфы, крахмала, белка и т.д.; лиофобные золи - слабое взаимодействие частиц дисперсной фазы с частицами дисперсионной среды. Золи металлов, гидроксидов, практически все классические коллоидные системы. ВМС и растворы ПАВ выделяют в отдельные группы. Существуют свободнодисперсные системы, имеющие подвижную дисперсную фазу, и связнодисперсные, дисперсная фаза которых неподвижна. Свободнодисперсные системы во времени непрерывно изменяют свой состав в сторону укрупнения частиц, поэтому их часто называют нестабилизированными. Связнодисперсные системы могут сохранять свою дисперсность на определённом постоянном уровне в течение длительного времени, поэтому называются стабилизированными.
2.Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Одним из выражений второго начала термодинамики является уравнение ΔG=ΔH+TΔC Наиболее общая формулировка второго начала термодинамики является: Энергия любого вида может переходить от одного тела к другому только в том случае, если термодинамический потенциал ее у первого тела выше, чем у второго. Энтропия (S) - функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии. S=(R/NA) ln ώ [Дж/(моль·К)] где R - универсальная газовая постоянная = 8,314 Дж/(моль·К) NA - постоянная Авогадро(6,023·1023) ώ – вероятность состояния системы
Энергия Гиббса – это свободная энергия при постоянном давлении. ΔG=H-TS. Эта разность между энтальпийным и энтропийным факторами позволяет судить о возможности самопроизвольного протекания хим.процесса в данном направлении. Это разность между энтальпийным и энтропийными факторами: G = H – TS ΔG = ΔH – TΔS Критериями направления самопроизвольного протеканиянеобратимых процессовявляются неравенства ΔG < 0 (для закрытых систем), ΔS > 0 (для изолированных систем). В ходе самопроизвольного процесса в закрытых системахG уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG = 0). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (TΔrS) фактором. Для реакций, у которых ΔrH < 0 и ΔrS > 0, энергия Гиббса всегда будет убывать, т.е. ΔrG < 0, и такие реакции могут протекать самопроизвольно при любых температурах.
|