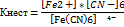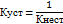Билеты 16Устойчивость комплексных соединений в растворах. Константа нестойкости комплекса. в водн. Р-рах комплексные соединения диссоциируют ступенчато, различают первичную и вторичную диссоциацию. ПЕРВИЧНАЯ – это диссоциация КС на комплексный ион и внешнюю сферу K4[Fe(CN)6]=4K++[Fe(CN)6]4- она протекает полностью, это диссоциация сильного электролита. Вторичная диссоциация протекает в очень малой степени из-за высокой прочности комплексного иона.
Константа устойчивости – это величина обратная константе нестойкости. Комплексный ион тем прочнее чем меньше велечина константы нестойкости и больше чем велечина константы устойчивости. Системы гемоглобинового и оксигемоглобинового буферов являются взаимопревращающимися системами. HCO3- щелочной резерв крови. Ацидоз- концентрация водородных ионов в крови становится выше границ нормы, при этом pH уменьшается.
Алколоз – наблюдается при уменьшении концентрации ионов водорода ниже границ нормы, уеличение pH до 8 приводит к быстрому летальному исходу.
Билет 17 Зависимость скорости реакции от концентрации. Порядок реакции кинетическое управление реакции первого и нулевого порядка. Порядок реакции и константа скорости реакции Показатели степени а и в кинетическом уравнении реакции называются порядком реакции по данному в-ву Порядок реакции это формальная велечина, может быть положительной, отрицательной, целым, дробным, нулевым, числом. Для нулевого: скорость реакции не зависит от концетрации в-ва и графически скорость реакции от концетрации дает прямую линию, параллельную оси абцис V=-dC/dt=kC0=k Для первого: V=-dC/dt=kC1 Для второга: V= -dC/dt=kC12 2) 2) Бу́ферные систе́мы кро́ви — физиологические системы и механизмы, обеспечивающие заданные параметры кислотно-основного равновесия в кровигидрокарбонатная буферная система является основным буфером плазмы крови и внеклеточной жидкости и составляет примерно 15% общей буферной ёмкости крови. Она представлена во внеклеточной среде угольной кислотой (Н2СОз) и гидрокарбонатом натрия (NaHCO3). Фосфатная буферная система представлена одно- и двузамещённым фосфорнокислым натрием (NaH2P04 и Na2HP04). Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду. Белковая буферная система выполняет роль внутриклеточной буферной системы. Обладая амфолитными свойствами. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa). Аминокислотная буферная система, только гистидин обладает незначительным буф. действием. H0=1670-3*1018=-1384; S= сумма прод-сумма исходных=508; |H|<|S| реакция не может сама протекать
|