Сировина та реактиви2 свіжих курячих яйця, кристалічний (NH4)2SO4, насичений розчин (NH4)2SO4. Приготування насиченого розчину (NH4)2SO4: 757 г солі розчиняють в 1 л води при слабкому нагріванні на водяній бані до повного насичення розчину (на дні колби повинен з'явитися осад нерозчиненої солі), закривают пробкою і старанно перемішують, при цьому осад повинен залишитися. Якщо осад розчиняється, необхідно додати кристалічної солі. Матеріали та обладнання Мірні циліндри з притертою пробкою на 50 та 100 мл, хімічні стакани на 50 мл, стакан на 500 мл, водострумний насос, ваги, водяна баня, ступка фарфорова з пестиками, штатив з пробірками, воронка Бюхнера, воронка скляна, скляні палички, фільтрувальний папір. Загальні відомості Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. Білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс). Молекули білків є лінійними полімерами, що складаються з 22 типів основних α-L-амінокислот (які є мономерами цих полімерів). При утворенні білка в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти утворюються пептидні зв'язки. Кінці білка називаються С- і N- кінцями (залежно від того, яка з груп кінцевої амінокислоти вільна: -COOH чи -NH2). Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом. Ця інформація представлена у вигляді нуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьох нуклеотидів — так званих кодонів. Відповідність амінокислоти до певного кодона в ДНК та мРНК відрізняється у різних організмів. Гомологічними називаються білки, що виконують одну функцію і мають загальне еволюційне походження. Наприклад, гомологічний білок гемоглобін різних організмів має в багатьох місцях ланцюга різні амінокислотні залишки, які називають варіабельними, на противагу консервативним, спільним залишкам. Структура білків. Виділяють чотири рівні структури білків (рис.3.1.).
Рис.3.1. Чотири рівні структури білків
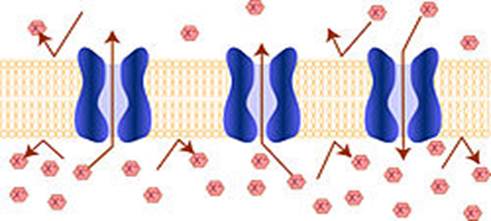
Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюгу. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка. Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюга, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають: α-спіралі, стабілізовані водневими зв'язками між пептидними групами і β-листи (кілька зигзагоподібних поліпептидних низок, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюга або між різними ланцюгами). Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура стабілізується нелокальними взаємодіями, формуванням гідрофобного ядра, а також завдяки утворенню водневих зв'язків, солевих містків, іонних взаємодій, дисульфідних зв'язків між залишками цистеїну.До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції. Домени — дещо більші елементи структури білка, що характеризуються стабілізацією незалежною від решти поліпептидного ланцюга, і часто виконують окрему функцію. В процесі еволюції елементи надвторинної структури можуть передаватися між генами або штучними методами генної інженерії Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом. Прості і складні білки. За складом білки діляться на прості і складні. Прості білки містять тільки амінокислоти, зв'язані в ланцюги. На відміну від них складні білки мають, крім амінокислот, додаткові групи, які називаються простетичними групами. Деякі простетичні групи служать кофакторами, необхідними для роботи ферментів. Прикладами органічних простетичних груп в складі білків служать гем (в складі гемоглобіну, цитохромів), тіамін, біотин та інші. Неорганічні простетичні групи найчастіше складаються з іонів металів, найпоширенішими з яких є цинк, магній і молібден, залізо. За типом простетичної групи складні білки поділяють на глікопротеїни, ліпопротеїни, хромопротеїни, нуклеопротеїни, фосфопротеїни, металопротеїни та інші. Функції білків в клітині різноманітніші, ніж функції інших біополімерів — полісахаридів і нуклеїнових кислот. Так, ферментні білки каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин. Класифікація білків за функцією може бути як біохімічною за типом біохімічної функції в організмі, так і заснованою на головних клітинних процесах. Класифікація включає: - обробку та збереження інформації (процеси реплікації, експресії генів та підтримки геному); - клітинні процеси та сигнали (контроль клітинного циклу, підтримка структури клітини та органів, транспорт, модифікації макромолекул, сигнальні системи); - метаболізм (отримання та перетворення енергії, синтез та транспорт ліпідів, амінокислот, цукрів, неорганічних молекул, вторинних метаболітів). Білки виконують специфічні завдання залежно від інформації, закодованої у відповідних генах. За винятком певних типів РНК більшість біомолекул часто розглядаються як інертні субстрати, на які діють білки. Білки складають половину сухої ваги клітин Escherichia coli, тоді як такі молекули як ДНК і РНК — лише 3% і 20%, відповідно. Каталітична функція. Найбільш важливою функцією білків в організмі є функція каталізу різних хімічних реакцій. Ферменти — тип білків, що характеризується специфічними каталітичними властивостями, тобто кожний фермент каталізує одну або декілька реакцій. Ферменти каталізують реакції розщеплювання (катаболізм) і синтезу (анаболізм) складних молекул, зокрема, синтез та деградацію ДНК, РНК, білків, ліпідів та цукрів. Крім того вони каталізують синтез та деградацію малих молекул, хімічні модифікації та ряд інших реакцій, необхідних для життєдіяльності. Відомо біля 4 тис. реакцій, що каталізуються ферментами, багато з них протікають поза межами клітин, наприклад фермент пепсин розщеплює білки в процесі травлення. Прискорення реакції в результаті ферментативного каталізу може проходити в 1017 разів швидше, ніж без каталізатора. Молекули, які змінюються в результаті реакції при посередництві ферментів, називаються субстратами. Хоча ферменти зазвичай складаються з сотень амінокислот, тільки невелика частина з них взаємодіє з субстратом, і ще менша кількість — в середньому 3-4 амінокислоти безпосередньо беруть участь в каталізі. Частина ферменту, яка з'єднується із субстратом і містить каталітичні амінокислоти, називається активним центром ферменту. Структурна функція. Структурні білки можуть надавати форму та жорсткість клітинам та тканинам є фібрилярними, інші формують за допомогою полімеризації глобул білок за певних умов. Структурну роль всередині клітини мають компоненти цитоскелету: наприклад глобулярні актин і тубулін в еукаріотів. Інші компоненти цитоскелету ─ фібрилярні білки також мають структурну функцію у забезпеченні структури окремих органів, наприклад, міжклітинний кератин важливий для підтримки структури волосся, нігтів і пір'я птахів. Колаген, ламінін і еластин важливі для підтримки епітелію стінок порожнинних органів —легенів, шлунка тощо. Колаген і еластин — основні компоненти сполучної тканини (наприклад, хряща). Захисна функція. Багато білків, що входять до складу крові, беруть участь в захисній відповіді організму як на пошкодження, так і на атаку патогенів. Прикладами першої групи білків служать фібриногени і тромбіни, що беруть участь в згортанні крові, а антитіла (імуноглобуліни), нейтралізують бактерії, віруси або чужорідні білки. Антитіла, що входять до складу адаптативної імунної системи, приєднуються до чужорідних для даного організму речовин, антигенів, і таким чином нейтралізують їх, направляючи до місць знищення. Антитіла можуть секретуватися в міжклітинний простір або закріплюватися в мембранах спеціалізованих В-лімфоцитів. Принципово іншим класом захисних білків (зазвичай пептидів) є токсини, що використовуються багатьма організмами для знищення хижаків і паразитів, тоді як власні клітини захищені від токсинів фізичним бар'єром, містять антидот (протиотруту), що локально нейтралізує токсин, або нечутливі до нього через іншу будову, ніж клітини жертви токсинів. Захист клітин від токсинів, шкідливих хімічних речовин з навколишнього середовища й продуктів власного метаболізму, а також багатьох фармацевтичних препаратів може здійснюватися мембранними білками-насосами. Різноманітність, специфічність і принцип дії таких білків-насосів, відкачуючих шкідливі речовини із клітин, сильно варіює від організму до організму. Широко розповсюдженим способом захисту бактерій від бактеріофагів є система рестрикції ─ модифікація. Рестриктаза розщеплює незахищену ДНК бактеріофагів. Існує багато інших способів і відповідних білків для захисту бактерій від фагів і еукаріотичних клітин від ДНК- та РНК-вірусів і бактерій. Сигнальна та регуляторна функція. Багато білків беруть участь в процесах передачі сигналів на міжклітинному та внутрішньоклітинному рівнях. Деякі білки, гормони, нейротрансмітери, фактори росту і цитокіни пептидної природи — позаклітинні сигнальні молекули, що передають сигнал від клітини, де вони були синтезовані, до інших клітин, як поряд із клітиною (нейротрансмітери, фактори росту), так і у віддаленних тканинах (гормони). До прикладів таких білків належить гормон інсулін, який регулює концентрацію глюкози в крові та фактор некрозу пухлин, що передає сигнали про запалення між клітинами організму. Інші молекули, залучені до сигнальної системи, — рецептори, що можуть бути як мембранними, так і цитоплазматичними або периплазматичними білками. Одна частина молекули рецептора сприймає сигнал, який за допомогою конформаційних змін передається на іншу частину молекули, що активує передачу сигналу на інші клітинні компоненти. У мембранних рецепторів частина молекули, що зв'язується з сигнальною молекулою, знаходиться на поверхні клітини, а домен, що передає сигнал, усередині. Часто рецептори є водночас і мембранними каналами, відповідь яких на зовнішній сигнал полягає в зміні концентрації певного іону в клітині. Транспортна функція. Розчинні білки, що беруть участь в транспорті малих молекул, зв'язують відповідний субстрат в одній частині клітини або організму, наприклад в місцях високої концентрації або при присутності додаткових регуляторних факторів, і легко вивільняють його в місцях низької концентрації субстрату або там, де відсутні згадані регуляторні молекули. Прикладом таких транспортних білків можна назвати гемоглобін, який переносить кисень з легень до решти тканин і вуглекислий газ від тканин до легень. Деякі мембранні білки беруть участь в транспорті малих молекул через біологічні мембрани, змінюючи їх проникність для цих молекул. Ліпідний компонент мембрани водонепроникний (гідрофобний), що запобігає дифузії полярних або заряджених (іони) молекул. Ці мембранні білки містять внутрішні канали, які дозволяють таким молекулам переміщатися всередину або назовні, та мають можливість відкривати або закривати їх за певними умовами. Багато іонних каналів спеціалізується на транспорті тільки одного іона, так калєві і натрієві канали розрізняють ці схожі йони і пропускають тільки один з них (рис. 3.2.).
Рис.3.2. Схематичне зображення іонних каналів в мембрані клітини Багато інших мембранних білків переносять макромолекули до окремих відділів клітини. Ще однією життєво важливою білковою транспортною системаю є електронтранспортний ланцюг, необхідний у процесах фотосинтезу та клітинного дихання. В результаті роботи цієї системи, електрони переносяться через мембрану проти електричного поля за рахунок енергії світла або катаболічної енергії, що отримується в циклі Кребса та при окисленні білків і ліпідів. Енергія, збережена у формі різниці електрохімічних потенціалів, використовується іншим білковим комплексом, АТФ-синтазою, для перетворення цієї енергії на АТФ, форму, зручну для використання іншими білками клітини. Моторна функція. Функцією молекулярних моторів є здійснення механічної роботи в межах клітини за рахунок хімічної або електричної енергії. Так моторні білки, підгрупа молекулярних моторів, переміщують клітинні «вантажі» уздовж філаментів. Моторні білки динеїни і кінезини транспортують молекули та органели вподовж мікротрубочок з використанням гідролізу АТФ як джерела енергії. Моторні білки часто відповідають і за макроскопічний рух організму. Наприклад, синхронізований рух багатьох молекул білка міозина приводить до скорочення м'язів. Для руху окремих клітин використовуються джгутики, ворсинки та інших відповідних органел клітини. Запасна (резервна) функція. У деяких системах класифікації виділяється окрема група білків, що виконують, головним чином, резервну і харчову функцію. Проте, майже усі білки використовуються в організмі як джерело амінокислот. Дуже важливо знати, що повноцінний білок містить у своєму складі усі незамінні амінокислоти. Неповноцінний білок містить у своєму складі не усі незамінні амінокислоти. Кожен білок унікальний за своєю структурою і функціями. Фізико-хімічні властивості білків Оптична активність. Кожна амінокислота, крім гліцину, містить один чи більше асиметричних атомів вуглецю, тобто проявляє оптичну активність. За абсолютною конфігурацією амінокислоти в організмі людини належать до L-ряду. Розчинність білків – велика спорідненість з водою (гідрофільність). Це пов’язано з гідратацією білкової молекули у результаті взаємодії диполів води з йонними (-NН2 і –СООН) і полярними (-ОН, -NН, -СО) групами в білковій молекулі. Вода навколо білкової молекули називається структурованою. Заряд білкової молекули та гідратна оболонка навколо білкової молекули надають стабільність розчинам білків. Розчинність білків у воді зростає при додаванні нейтральних солей незначної концентрації. Йони солей взаємодіють з протилежними зарядами білка, екранують заряджені групи білкових молекул і тим самим зменшують білкову взаємодію. Зворотну дію здійснює підвищення концентрації солей. Амфотерність білкових молекул – здатність проявляти кислий або основний характер. Ізоелектрична точка білка – значення рН середовища, при якому білок не несе сумарного заряду, тобто число негативних зарядів зрівнюється з числом позитивних зарядів. У кислому середовищі сумарний заряд білкової молекули позитивний, тому вона рухається до катоду (─). У лужному середовищі сумарний заряд білкової молекули негативний, тому вона рухається до аноду(+). При значенні рН, що відповідає ізоелектричній точці, білок не рухається в електричному полі. Висолювання – процес осадження білків нейтральними солями. При цьому руйнується гідратна оболонка і нейтралізуються заряди білкової молекули. Такі білки зберігають свої природні властивості і функції після видалення солі. Емульгуючі властивості білка – білок утворює на поверхні крапель жиру (за рахунок гідрофобної взаємодії) тонку плівку, яка притягує воду (за рахунок полярних груп) і протидіє злипанню жирових часток. Казеїн молока емульгує (стабілізує) природну емульсію – молоко. Денатурація білків – під дією різних фізичних і хімічних факторів порушується природна просторова структура білкової молекули: руйнуються четвертинна, третинна і вторинна структури (первинна не змінюється). Це призводить до зменшення або повної втрати розчинності, специфічної біологічної активності, зміни оптичних властивостей, в’язкості та ін. При денатурації розриваються йонні, водневі і дисульфідні зв’язки, поліпептидний ланцюг розкручується і знаходиться або в розгорнутому стані, або у вигляді хаотичного клубка. Відбувається перебудова структури білкової молекули. Білок втрачає свої нативні властивості і розчинність. Для більшості білків це незворотний процес, але для деяких, наприклад, білків м'язів – зворотний. Денатурації білка в побуті — приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білок овальбумін стає щільним, нерозчинним і непрозорим. Білки, що використовуються в технологічних методах і вимагають нетипових умов, часто підбираються з екстремофілів — організмів, здатних проживати в екстремальних умовах. Так, наприклад, ДНК-полімераза Taq, що використовується в полімеразній ланцюговій реакції (ПЛР), може витримувати без денатурації багаторазове нагрівання до 95 °C. Вона була спочатку виділена з бактерії Thermus aquaticus. Денатурація може бути зворотною, наприклад при висолюванні водорозчинних білків за допомогою солей амонію, що використовується як спосіб очищення білків. Реакції осадження білків можна розділити на дві групи: а) практично незворотні реакції осадження, при яких білки зазнають глибокі зміни і не можуть бути знов розчинені в первинному розчиннику: в цьому випадку має місце денатурація білка; до необоротних реакцій відносяться осадження білку солями важких металів, алкалоїдними реактивами, мінеральними, органічними кислотами і осадження при нагріванні; б) зворотні реакції осадження, при яких білки, не піддаються глибоким змінам і тому можуть бути розчинені в первинному розчиннику; молекули білка при цьому зберігають свої первинні, включаючи біологічні, властивості і не піддається денатурація. До зворотних реакцій осадження слід віднести реакції осадження білків органічними розчинниками (спиртом або ацетоном) і реакції висолювання білків (осадження під впливом концентрованих розчинів нейтральних солей лужних і лужноземельних матеріалів). Осадження білків при нагріванні. Випадання білків в осад при нагріванні (звертання) – характерне майже для всіх білків (виключення складає желатина, яка не руйнується при нагріванні). Особливо легко і більш повно відбувається осадження білка в слабокислому середовищі, поблизу від ізоелектричної точки. У нейтральному і сильнокислому середовищах осадження білків йде значно гірше, а в лужному середовищі зовсім не спостерігається. На відміну від осадження солями білків при нагріванні – денатурація білків – незворотна. Реакція денатурації проходить поступово і прискорюється з підвищенням температури, тому короткочасне нагрівання може і не призвести до коагуляції. Присутність солей і концентрація водневих йонів відіграють важливу роль у випаданні в осад денатурованого при нагріванні білку. Найбільш повна і швидка коагуляція має місце в ізоелектричній точці білку, тобто при такій величині рН, коли колоїдні частинки білку найменш стійкі. Деякі білки, що мають в своєму складі багато дисульфідних зв’язків, стійких до високої температури, здатні до ренатурації і не втрачають своєї структури та функціональної активності після припинення дії високої температури (ферменти трипсин та рибонуклеаза). Осадження білків концентрованими органічними і мінеральними кислотами. При дії на білок концентрованих мінеральних і органічних кислот відбувається денатурація білка внаслідок дегідратації та утворення комплексних солей білка з кислотами. У надлишку всіх мінеральних кислот, крім азотної, осад білка розчиняється. Реакція осадження концентрованою азотною кислотою лежить в основі кількісного визначення білка за методом Робертса-Стольнікова-Брандберга. Осадження білку концентрованими мінеральними кислотами (окрім ортофосфорної кислоти) пояснюється як явищами дегідратації білкових частинок і нейтралізації їх зарядів, так і з інших причин (денатурацією, утворенням солей). У надлишку сульфатної або хлоридної кислот, а також при їх тривалій дії, осад денатурованого білку розчиняється, за рахунок перезарядки білку і часткового гідролізу. У надлишку нітратної кислоти цього розчинення не відбувається (супутній нітрат-йон заважає перезарядці білкової молекули). Механізм осадження білків органічними кислотами пояснюється дегідратацією білкової молекули і зняттям заряду. Осадження трихлороцтовою кислотою надає можливість відокремити білки від пептидів та амінокислот (білковий азот відділяється від небілкового). Відбувається незворотна реакція осадження. Осадження білків солями важких металів. Солі важких металів (Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg та ін.) осаджують білки з розчинів, утворюючи солеподібні і комплексні сполуки, що розчинні у надлишку цих солей, але нерозчинні у воді. Це пояснюється тим, що надлишок іонів металу, адсорбуючись, спричиняє перезарядку білкового комплексу, внаслідок чого в розчин переходить комплекс зміненого білка з металом. Це явище називається адсорбційною пептизацією. Властивість білка міцно зв’язувати іони важких металів у вигляді нерозчинного осаду у воді використовується при отруєнні солями ртуті, міді, свинцю тощо. Рекомендують одразу ж після отруєння вживати білки молока або яєць, доки ці солі знаходяться ще в шлунку і не встигли всмоктатись. Після чого у хворого викликають блювоту, щоб вивести отруту. Кристалізація. Кристали білків та інших макромолекул вирощуються в розчині. Найзагальніший підхід — поступове зниження розчинності його компонентів, молекули осаджуються з розчину, формуючи аморфний осад на дні посудини (рис.3.3.).
Рис.3.3. Кристали білків розмірами від 0,1 до 1 мм для кристалографії. Фотографія в поляризованому світлі
Ріст кристалів в розчині характеризується двома стадіями: нуклеація, тобто утворення мікроскопічного ядра кристалу (що має біля 100 молекул), та росту цього ядра до розмірів, необхідних для рентгеноструктурного аналізу. Зазвичай умови підбираються сприятливими для росту кристалу. Надзвичайно важко передбачити умови, оптимальні для росту ідеально впорядкованих кристалів. Для кристалізації різних білкових молекул використовуються різні умови: зміна pH, додавання центрів кристалізації, зміну температури для підбору швидкості кристалізації або для створення перенасиченого розчину. Ці методи вимагають великої кількості досліджуваної речовини високого рівня очистки у випадку білків. Відомо декілька чинників, що перешкоджають кристалізації. Наприклад, кристали тримають при постійній температурі і захищають від вібрацій, які перешкоджали б отриманню якісного кристалу. Домішки в розчині часто заважають кристалізації. Кристали можуть псуватися при сполученні кількох центрів кристалізації. Висолювання білків. Висолювання – це зворотна реакція осадження білків нейтральними солями лужних та лужноземельних металів різних концентрацій. Реакція висолювання зумовлена дегідратацією макромолекул білка з одночасною нейтралізацією його електричного заряду. Для висолювання найчастіше застосовуються такі солі: (NH4)2SO4, NаСI, Nа2SO4, MgSO4. Білки, що осаджуються, не зазнають глибоких структурних змін і їх осади можна знову розчинити у вихідному розчиннику, а молекула білка зберігає при цьому свої попередні нативні властивості. Реакції осадження білків органічними розчинниками (спиртом, ацетоном) за умов нетривалої дії і низької температури можуть також бути зворотними. Метод висолювання широко використовується для фракціонування суміші білків, коли треба відокремити один білок від іншого (наприклад відділити альбуміни від глобулінів у білку курячого яйця). Грубодисперсні білки ─ глобуліни висолюються значно легше, ніж альбуміни напівнасиченим розчином сірчанокислого амонію, тоді як альбуміни – насиченим розчином. Розділення альбумінів і глобулінів методом висолювання Альбуміни і глобуліни є найбільш поширеними в природних об'єктах білками. Звичайно вони зустрічаються разом і відділення їх один від одного основане на різній їх розчинності у воді і різній здатності до висолювання мінеральними солями. Висолювання це класичний метод розділення альбуміну і глобулінів заснований на осадженні останніх, 2 М сульфатом амонія (50% -ве насичення). Альбумін осідає лише 4 М сульфатом амонія (100% -ве насичення). Замість сульфату амонію можуть бути використані і інші нейтральні солі - сульфат натрію, сульфат магнію, суміші одно- і двохзаміщених фосфатів та ін. Проте найбільше поширення для осадження білків отримав сульфат амонію. Це обумовлено головним чином тим, що його висока розчинність у воді поєднується з її незалежністю від температури. Навпаки, такі осаджувачі, як, сульфат натрію, мають обмежену сферу застосування через низьку розчинність при температурі, близькій до 0°. Сульфат амонію дуже зручний також тим, що не чинить денатуруючої дії на найбільш лабільні з відомих білків. Висолювання білків є зворотним процесом: після виведення солі шляхом діалізу або розведенням водою білок знову розчиняється і відновлює свої нативні властивості. Це можна пояснити наступним чином: у водному розчині молекули білків заряджені і гідратовані. Молекули солей руйнують гідратну оболонку і знімають заряд з білкової молекули шляхом адсорбції на ній йонів солей. Внаслідок цього молекули білків злипаються і випадають в осад. Для різних солей потрібне різне значення рНсередовища для висолювання білків. Так, амоній сульфат висолює білки у слабкокислому середовищі. Хід роботи Білок 2 свіжих курячих яєць відділяємо від жовтків і вміщуємо в мірний стакан на 100 мл. Зважуємо одержаний білок в г та вимірюємо його об¢єм в мл. Вага білку (г): 2 = Вага білку (г) 1 яйця. Одержання осаду глобуліну. При постійному перемішуванні яєчний білок змішуємо з рівним об'ємом насиченого розчину сульфату амонію і добре перемішуємо розчин скляною паличкою. При утворенні 50%-ного білкового розчину сульфату амонію випадають в осад глобуліни. Осад відфільтровують через складчатий бумажний фільтр або центрифугуванням. До осаду додають такий же об¢єм дистильованої води, вимірють загальний об¢єм одержаного розчину і визначають в ньому концентрацію білку (Кглобуліну) біуретовим методом, в мг/мл. Знаючи загальний об¢єм розчину глобуліну Vглобуліну (мл) та концентрацію білку можна визначини кількість глобуліну в яєчному білку, одержаному з 2 яєць. Кглоб х Vглоб = кількість глобуліну (г) в білку 2 яєць Далі визначаємо кількість глобуліну (г) в білку 1 курячого яйця. Одержання осаду альбуміну. Після осадження глобуліну отримуємо прозорий фільтрат. Вимірюємо об¢єм фільтрату в мл та визначаємо концентрацію білку біуретовим методом. Викладач розливає фільтрат в скляні стаканчики по кількості бригад в групі. Кожна бригада вимірює одержаний нею об¢єм в мл. Для висолювання альбуміну до фільтрату додають тонко подрібнений порошок (NН4)2S04 до повного насичення, тобто до тих пір, поки нова порція порошку залишиться нерозчиненою (з розрахунку 13,5 г на 100 мл розчину білку). Випадає осад альбуміну. Одержаний осад відфільтровують на воронці Бюхнера під вакуумом. Обережно знімають осад з фільтрувального паперу, змивають залишки осаду 3-4 мл дистильованої води і вимірюють одержаний об¢єм розчину альбуміну Vальбуміну (мл). Визначають концентрацію білку Кальбуміну біуретовим методом та розраховують кількість білку альбуміну в грамах. Кількість білку в грамах кожна бригада визначає як добуток його концентрації в розчині (мг/мл) на об¢єм розчину (мл), після розчинення осаду альбуміну. Кальб х Vальб = кількість альбуміну (г) одержана в бригаді Знаходять сумарну кількість альбуміну в г одержану всіма бригадами та визначають кількість альбуміну, що міститься в 1 яєчному білку. ΣА1+ А2 + Аn = кількість альбуміну в г одержана всіма бригадами, яка дорівнює кількості альбуміну в білку 2 яєць. Далі визначаємо кількість альбуміну (г) в білку 1 курячого яйця. Знаючи вагу білку 1 курячого яйця, кількість альбуміну та глобуліну, одержаного з 1 яйця, визначаємо % глобуліну та альбуміну в білку 1 яйця. Завдання для виконання 1. Відділити білки 2 курячих яєць від жовтків. 2. Виміряти одеражий об'єм і вагу білку. 3. Додати насичений розчин сульфату амонію. 4. Відфільтрувати утворений осад глобуліну. 5. Розчинити осад глобуліну та визначити концентрацію білку (мг/мл). 6. Визначити об'єм та концентрацію білку у фільтраті з альбуміном. 7. Отримати на бригаду частину фільтрату. 8. Виміряти одеражий об'єм фільтрату і його вагу. 9. До фільтрату додати порошок сульфату амонію. 10. Відфільтрувати утворений осад альбуміну. 11. Розчинити осад в 1-3 мл води. 12. Визначити об'єм розчиненого осаду (мл) та концентрацію білку (мг/мл). 13. Визначити відсоток альбуміну та глобуліну від загального білку 1 яйця. 14. Написати висновок.
Контрольні запитання 1. Що таке білок. 2. Структура білків. 3. Прості і складні білки. 4. Денатурація білків 5. Функції білків (каталітична, структурна, захисна, сигнальна, регуляторна, транспортна, моторна, запасна функція). 6. Фізико-хімічні властивості білків. 7. Реакції осадження білків. 8. Кристалізація. 9. Висолювання білків 10. Розділення альбумінів і глобулінів методом висолювання 11. При якій концентрації сульфату амонію випадає в осад глобулін та альбумін.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА 1. Шмидт, В. Оптическая спектроскопия для химиков и биологов / В. Шмидт.- М.: Техносфера, 2007. - 368 с. 2. Нельсон, Д. Основы биохимии Ленинджера. В 3 т. / Д. Нельсон, М. Кокс. - М.: Бином. Лаборатория знаний, 2012. - 694 с.
|