Задача 766
Вычислить рН 0, 175 М раствора азотной кислоты. Решение: Азотная кислота – сильный электролит, ее активная концентрация будет отличаться от истинной. Поэтому в таких случаях надо вносить поправку на активность электролита. Находим предварительно ионную силу раствора HNO3:
В табл. 6 прил. находим коэффициент активности иона Н+ для вычисленной ионной силы раствора fH+ = 0, 838. Определяем активность ионов водорода: аH+ =f· См=0, 838· 0, 175=0, 147. Вычисляем водородный показатель: pH = -lg аH+ = - lg 0, 147 = pH = 0, 83. При выполнении заданий рекомендуется использовать методические указания [8] и табл. 6, 7 приложения.
В задачах 754–765 вычислить рН 0, 1М растворов слабых электролитов по величине их констант диссоциации (табл. 7 приложения)
|

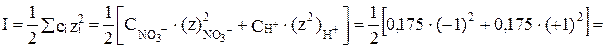
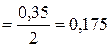 .
.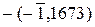 = –(–1 + 0, 1673) = 0, 8327;
= –(–1 + 0, 1673) = 0, 8327;


