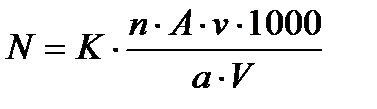Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Качественный и количественный анализ водорослей и цианобактерий. В настоящее время в гидробиологической практике используются несколько способов концентрирования проб фитопланктона; осаждение водорослей в сосудах, фильтрация через сита или мембранные фильтра и центрифугирование собранного материала. Широко используются наиболее простой способ (метод отстаивания проб в сосудах), предложенный в 1915 г. Р.Г. Гринбергом и модифицированный П.И.Усачевым. Он не требует сложного оборудования. Фиксированные пробы отстаивают в сосудах в неподвижном состоянии в темном месте. При объеме пробы 2 литра время отстаивания 12-15 суток, при 1 л- 8-10 сут., 0,5 л - 4 сут. (Садчиков, 2003). За это время водоросли успевают осесть на дно сосуда. Однако необходимо иметь в виду, что пробы с детергентом быстро разрушаются, поэтому они должны быть обработаны сразу же после их концентрирования. После осаждения водорослей пробу концентрируют путем сливания среднего слоя воды, при скорости падения уровня в пробе менее 3 см/ч, до объёма 30-80 мл необходимо быть крайне осторожным. Чтобы не нарушить осадка и не допустить засасывания водорослей из поверхностного слоя. Для этого используют тонкий стеклянный сифон с загнутым на 2 см. вверх концом. Сгущенную таким образом пробу взбалтывают и замерив его объём, переносят в сосуд меньшего объёма. При необходимости пробу концентрируют до объема 5-10 мл центрифугированием (1000-2000 об. /мин в течение 5-10 мин). Полученный таким способом материал пригоден для исследований в счетной камере. Консервация и хранение проб фитопланктона.Для консервирования и предохранения фитопланктона от разрушения при длительном хранении используются разнообразные химические соединения и их смеси. Консервацию осуществляют сразу же после отбора проб добавлением к ним фиксирующего реагента. Поскольку ни один из применяемых фиксаторов не может быть предпочтен всем прочим, важно учитывать достоинства и недостатки каждого при использовании их в повседневной работе. Хорошую сохранность водорослей обеспечивает раствор формальдегида и хромовых квасцов (1 мл 4%-ного формальдегида и 10 г K2S04 Cr(S04)3 24Н20 в 100 мл пробы). Такие пробы могут сохраняться достаточно долго без заметного разрушения клеток фитопланктона. Исключение составляют жгутиковые водоросли, нежные клетки которых довольно быстро разрушаются после фиксации формалином. Методы качественного изучения материала.Собранный материал предварительно просматривают под микроскопом в живом состоянии в день сбора, чтобы отметить качественное состояние водорослей до наступления изменений, вызванных хранением живого материала или фиксацией проб (образование репродуктивных клеток, переход в пальмеллевидное состояние, разрушение клеток, колоний, потеря жгутиков и подвижности и т.д.). В дальнейшем собранный материал продолжают изучать параллельно в живом и фиксированном состоянии. Работа с живым материалом является необходимым условием успешного изучения водорослей, изменяющих при фиксации форму тела, форму и окраску хлоропластов, теряющих жгутики, подвижность или даже полностью разрушающихся в результате воздействия фиксаторов. Чтобы сохранить материал живым, следует всячески оберегать его от перегрева, загрязнения фиксаторами, а к изучению приступать как можно скорее. Водоросли в живом состоянии изучают с помощью световых микроскопов различных марок с использованием разных систем окуляров и объективов, в проходящем свете с соблюдением обычных правил микроскопирования. Для микроскопического изучения водорослей готовят препараты: на предметное стекло наносят каплю исследуемой жидкости и накрывают ее покровным стеклом. При длительном изучении препарата жидкость под покровным стеклом постепенно подсыхает, и ее следует добавлять. Для различных отделов и экологических группировок, так и разнообразием целей и подходов к их изучению. В связи с тем, что большинство водорослей имеет микроскопические размеры, обнаружить их невооруженным глазом в естественных местообитаниях, как правило, возможно лишь при условии массового развития, вызывающего изменение окраски среды обитания: воды, почвы или другого субстрата (Вассер и др.,1989). Подсчет численности водорослей осуществляется в специальной счетной камере определенного объема: Нажотта (0,01 см³). Площадь дна камеры составляет 1 см² и высотой 100 мкм. Дно камеры разделено продольными линиями на 40 полос по ширине каждой 250 мкм и длине 10 мм. Перед счетом проба тщательно перемешивается продуванием воздухом через чистую трубку с входным отверстием не менее 2 мм, и затем одна капля пробы этой же трубочкой вносится в счетную камеру. Камера закрывается покровным стеклом, и после оседания водорослей (10-15 мин) проводится осмотр пробы и определение видового состава всех встречных водорослей. Подавляющее большинство водорослей хорошо определяется в фиксированном состоянии. При исследовании количественных проб фитопланктона пересчет численности организмов на 1 л воды производили по формуле:
N – Количество организмов в литре воды исследуемого водоема; K – Коэффициент, показывающий во сколько раз объем счетной камеры меньше 1 см3; n – Количество организмов, обнаруженных на просмотренных дорожках (квадратах); A – Количество дорожек (квадратов) в счетной камере; a - количество дорожек, на которых производился подсчет водорослей; v– Первоначальный объем отобранной пробы (см3); V – Объем концентрата пробы (см3). При определении видовой принадлежности использовались руководства по соответствующим группам (Асаул, 1975; Голлербах и др., 1953; Дедусенко – Щеголева, Голлербах, 1959, 1962; Забелина и др., 1951; Кондратьева и др., 1984; Матвиенко, Догадина, 1978; Попова, 1955; Топачевский, Оксиюк, 1960; Царенко, 1990; Кузяхметов, Шкундина и др., 1995; Минибаев, Шкундина и др., 2003; Шкундина и др., 2012). 2.2. Методика определения токсичности воды по показателям кресс-салата (Lepidium sativum L.) В последнее время предлагается метод прорастания тест-растений в исследуемых водных средах. Широко используются семена кресс-салата. Сроки прорастания, интенсивность роста корешков и проростков легко определить визуально, что делает этот биотест удобным (Зейферт, 2010). В условиях антропогенного воздействия в водные объекты могут попадать сотни тысяч индивидуальных загрязняющих веществ различной токсичности и устойчивости. Поэтому, полный анализ вод по индивидуальным соединениям, а тем более по формам их существования является нереальной задачей (Заваров, 2007). Отбор проб осуществлялся согласно ГОСТ 17.5.05-85 «Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков» и ГОСТ Р 5159-2000 «Вода.Общие требования к отбору проб». Оборудование и реактивы: семена кресс-салата (одинаковые по размеру, одного урожая), чашки Петри, пробы воды, линейка, бумага фильтровальная. Биотестирование проводят в чашках Петри по три повторности на каждую пробу. На дно вырезаются диски из фильтровальной бумаги, которые будут являться своеобразным субстратом. В каждую чашку на поверхность субстрата укладывают по 30 семян кресс- салата. Расстояние между соседними семенами должно быть по возможности одинаковым. Семена покрывают такими же дисками из фильтровальной бумаги, какие были на дне чашки. Фильтровальную бумагу во всех чашках увлажняют исследуемой неразбавленной водой или талым снегом до появления признаков насыщения. Одна из проб с дистиллированной водой, не содержащая токсических соединений, является контрольной, по морфометрическим показателям кресс-салата, пророщенного в данной пробе, проводят сравнительный анализ с показателями фитотеста других исследуемых проб. Чашки Петри этикетируют, закрывают и проращивают семена в термостатическом шкафу. В течение 7-10 дней следят за прорастанием семян, периодически увлажняя дистиллированной водой. Избыток воды удаляются ватой. Проращивание ведут в помещении при температуре 20-25˚С. Нормой считается прорастание 90-95 % семян в течение 3-4 суток. Процент проросших семян от числа посеянных называется всхожестью. По истечению опыта измеряют показатели фитотеста: длину главного корня, длину побега, средний сухой вес, всхожесть, энергию прорастания, дружность прорастания (ПНД Ф Т 14.1:2:4.19-2013).
|