Обработка данных испытания
7.1 По таблице П3 приложения пересчитывают концентрации исходной смеси хн и дистиллята хд из об. % в мас. %, а также находят значения плотности при этих концентрациях ρн и ρд. Пересчет концентраций для водно-спиртового раствора из объемных xоб в массовые xмас можно произвести также по формуле xмас = 789,27·xоб / ρ;, где ρ; – плотность раствора в кг/м3, соответствующая концентрации xоб и температуре 20°С. Определяют массу исходной смеси и дистиллята-ректификата Мн = Vн ·ρн / 1000; Мд = Vд ·ρд / 1000. Из уравнения материального баланса находят массу кубового остатка Мк = Мн – Мд и его массовую концентрацию в процентах xк = (Мн ·xн – Мд ·xд )/ Мк. Определяют массу прошедшей воды за время ректификации τ; Мв = Gв· τ;. 7.2 Исходя из уравнения теплового баланса процесса разогрева куба-испарителя, определяют время доведения исходного раствора до температуры кипения. Если разогрев осуществляется при мощности Nнагр в течение времени τнагр, то подведенное за это время количество теплоты Nнагр · τнагр затрачивается на нагрев исходной смеси Qсм, стенок куба-испарителя Qст и потери в окружающую среду Qокр, т.е. Nнагр · τнагр = Qсм + Qст+ Qокр. Количество теплоты, приобретенной исходной смесью, можно определить по формуле Qсм = Мн·;(сн·tн – со·tо), где tн, tо – конечная и начальная температуры исходной смеси, °С; начальная температура tо обычно равна температуре окружающей среды tокр, а конечная tн – температуре кипения исходного раствора, и принимается согласно таблицы П5 приложения в зависимости от концентрации хн. сн, со – удельные теплоемкости исходной смеси в конце и начале ее разогрева, определяемые по таблице П2 в зависимости от массового содержания спирта в исходной смеси хн и при температуре соответственно tн и tо. Количество теплоты, затраченное на нагрев стенок куба-испарителя от температуры окружающей среды tокр до температуры стенки tст1, равно Qст = Мст·сст·;(tст1 – tокр ), где Мст – сухая масса куба-испарителя, равная для данной установки 3,6 кг; сст – удельная теплоемкость материала, из которого изготовлен куб; для нержавеющей стали 12Х18Н10Т сст = 485 Дж/(кг· оС); tст1 – температура наружной стенки куба-испарителя в момент начала кипения раствора; Потери теплоты в окружающую среду можно рассчитать по формуле Qокр = α·Δtср·F·τнагр, где α; – коэффициент теплоотдачи от наружной стенки куба-испарителя к воздуху, ориентировочно можно принять равным α = 9,47 +0,07·Δtср; (7.1) Δtср – средняя разность температур между наружной стенкой куба и окружающим воздухом в процессе нагрева и доведения раствора до кипения, равная Δtср = (tст1 – tокр)/ 2; F – площадь поверхности куба-испарителя; определяется расчетным путем при известных геометрических размерах куба-испарителя. 7.3 Составляют тепловой баланс для дефлегматора и холодильника, пренебрегая потерями теплоты в окружающую среду. Так как теплота, выделенная при конденсации паров в дефлегматоре Qдеф, а также при охлаждении дистиллята в холодильнике Qхол, воспринимается водой, следует Мв ·cв·;( где cв – теплоемкость воды,равная 4190 Дж/(кг· оС);
Количество теплоты, отданное дистиллятом в холодильнике, определяется в Дж по формуле Qхол = (tф – tд) · Мд ·сд, (7.3) где tф – средние значения температура флегмы из всех испытаний; сд - теплоемкость дистиллята, которую определяют по таблице П2 приложения в зависимости от массовой концентрации хд при средней температуре дистиллята в холодильнике tср = (tф + tд) / 2. В дефлегматоре конденсируются все пары, которые в дальнейшем разделяются на дистиллят Мд и флегму Мф. При этом флегмовое число равно R = Мф / Мд, тогда Qдеф = (Мд + Мф) · (iп – сф· tф) = Мд· (R+ 1)·(iп – сф· tф), (7.4) где iп – энтальпия пара, Дж/кг (находится из таблицы П4 приложения в зависимости от массовой концентрации спирта в парах yп = хф = хд); сф – теплоемкость флегмы, определяемая по таблице П2 в зависимости от массового содержания спирта во флегме хд и при температуре флегмы tф. Из уравнения теплового баланса (7.2) с учетом уравнений (7.3) и (7.4) определяют величину рабочего флегмового числа колонны, при котором произведена ректификация R = [ Мв·св· (tвк ‑ tвн) – Мд·сд· (tф – tд)]/ [ Мд· (iп – сф ·tф)] – 1. 7.4 Составляют тепловой баланс для ректификационной колонны: N·τ + Мн·сн·tн + R·Мд·сф·tф = Мд· (1 + R) ·iп + Мк·ск·tк + Qп·τ;, (7.5) где N – мощность электрокипятильника, при которой произведена ректификация, Вт; τ; – длительность процесса ректификации, с; Qп – потери теплоты в окружающую среду, Вт. Потери теплоты в окружающую среду можно определить из уравнения теплового баланса (7.5), а также по уравнению Qп = α·Δtср·F, где Δtср – средняя разность температур между наружной стенкой и окружающим воздухом, равная Δtср = tст.ср – tокр; α; – коэффициент теплоотдачи от наружной стенки куба-испарителя к воздуху, определяемый по формуле (7.1). 7.5 Пересчитывают концентрации исходной смеси хн и дистиллята хд из мас. % в мол. % по соотношению xмол = (100·xмас / 46,07) / [ xмас / 46,07 + (100 – xмас ) / 18,02 ], где 46,07 и 18,02 – молекулярные массы соответственно этанола и воды, кг/кмоль. 7.6 По данным таблицы П5 приложения, как показано на рисунке 2, строят диаграмму фазового равновесия (кривая 1) и рабочую линию колонны (прямая 2), соответствующую уравнению y = R· x / (R + 1) + xд / (R + 1).
Рисунок 2 – Кривая фазового равновесия – 1, рабочая линия процесса – 2 и графические построения к определению числа теоретических тарелок колонны и минимального флегмового числа 7.7 Для построения рабочей линии восстанавливают перпендикуляр из точки на оси абсцисс, соответствующей значению хд мол. % до пересечения с диагональю – точка A; рассчитывают величину В = xд / (R + 1) в мол. % и откладывают ее значение на оси ординат – точка В. Соединяя точки A и В, получают рабочую линию колонны AC. Определяют число теоретических тарелок nт, как число ступенек между рабочей и равновесной линиями в пределах от хд до хн (т. е. до перпендикуляра, восстановленного из точки на оси абсцисс, соответствующей концентрации исходной смеси хн мол. % до рабочей линии). Число теоретических тарелок может быть дробным. 7.8 Определяют высоту насадки, эквивалентную теоретической тарелке – теоретической ступени изменения концентрации, называемую ВЭТТ. Эта величина служит для оценки эффективности работы колонны и определяется по формуле ВЭТТ = Нкол / nт, где Нкол – высота массообменной части колонны, которую измеряют на действующей установке. 7.9 Рассчитывают удельный расход энергии на ректификацию безводного спирта (дистиллята) в кВт·ч/кг по формуле q = N · τ ·100 / (xд · Мд). 7.10 Флегмовое число может быть изменено от минимального значения Rmin до бесконечности. Минимальному флегмовому числу соответствует бесконечно большое число теоретических тарелок и минимальный расход энергии. Определить минимальное флегмовое число можно, если восстановить перпендикуляр из точки на оси абсцисс хн до равновесной линии (точка C1 на рисунке 2), и провести линию через точки A и C1 до пересечения с осью ординат, а затем найти величину отрезка Вmax в мол. %, тогда Rmin = (xд – Вmax) / Вmax. Флегмовое число Rmin также можно определить на диаграмме по рисунку 2 как отношение величин отрезков Rmin = C1D / C1E = (xд – yнр) / (yнр – xн). Следует отметить, что кривая фазового равновесия этанол – вода в верхней части имеет такой изгиб, при котором соединить точки A и C1, не пересекая кривой фазового равновесия в других местах (особенно при высоких концентрациях xд), не всегда удается. В таких случаях минимальное значение Rmin следует определять только графическим путем по диаграмме x – y, проведя из точки A касательную к кривой фазового равновесия до пересечения с осью ординат, а затем найти величину Вmax и Rmin. Отношение рабочего и минимального флегмовых чисел называют коэффициентом избытка флегмы К = R / R min.
|

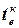 –
– 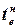 ) = Qхол + Qдеф, (7.2)
) = Qхол + Qдеф, (7.2)



