Состав и пространственная организация белковой молекулы
Государственное образовательное учреждение высшего профессионального образования УЛЬЯНОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Белки представляют собой биополимеры, состоящие из аминокислотных остатков, соединенных пептидными связями. Известно более 170 аминокислот, но только 20 из них входят в состав белков. Их называют протеиногенными.
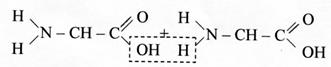  При взаимодействии аминокислот друг с другом образуются прочные ковалентные (пептидные) связи между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты: При взаимодействии аминокислот друг с другом образуются прочные ковалентные (пептидные) связи между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты:
Длина пептидной связи составляет 0,1325 нм, представляя собой среднюю величину между длинами одинарной С-N связи (0,146 нм) и двойной С=N связи (0,127 нм), т. е. пептидная связь частично имеет характер двойной связи. Это сказывается на свойствах пептидной группировки: · пептидная группировка имеет жесткую планарную структуру, т. е. все атомы, входящие в нее, располагаются в одной плоскости; · атомы кислорода и водорода в пептидной группировке находятся в транс -положении по отношению к пептидной С-N связи (рис. 2); ·
В каждой белковой молекуле порядок чередования аминокислот и их количество строго определены, в норме постоянны и закодированы в ДНК. Перестановка аминокислотных остатков или замена одного из них может привести к серьёзным нарушениям процессов, протекающих в клетке. Например, замена в β-цепи гемоглобина человека остатка глутаминовой кислоты на остаток валина приводит к тяжелому, передающемуся по наследству заболеванию – серповидноклеточной анемии. Различают несколько уровней структурной организации белков: первичную, вторичную, третичную и четвертичную структуры. Под первичной структурой белка понимают порядок чередования аминокислотных остатков в полипептидной цепи белка, соединенных пептидными связями: … - Гли – Вал – Тир – Глн – Сер – Ала – Иле – Асн – Лиз – Ала – … Вторичная структура белка – это упорядоченное расположение отдельных участков основной цепи полипептида, без учета расположения боковых цепей (радикалов аминокислотных остатков). Все вторичные структуры стабилизированы водородными связями между кислородом карбонильной группы и водородом амидной группы: С=О…Н–N. Существуют три основных типа вторичной структуры: · Рис. 3. α-спираль (а) и β-складчатая антипараллельная структура (б) · β-структура или структура складчатого листа (рис. 3б). Остовы пептидных цепей скручены не в спираль, а имеют зигзагообразную конфигурацию. В отличие от α-спирали,в β-структуре водородные связи возникают не внутри цепи, а между параллельно или антипараллельно идущими и сближенными участками цепи. β-структура (как и α-спираль) является наиболее термодинамически выгодным состоянием для данного участка полипептидной цепи. · Вторичная структура белка определяется первичной. Аминокислотные остатки в разной степени способны к образованию водородных связей, это и влияет на образование α-спирали или β-слоя. К спиралеобразующим аминокислотам относятся аланин, глутаминовая кислота, глутамин, лейцин, лизин, метионин и гистидин. Если фрагмент белка состоит главным образом из перечисленных выше аминокислотных остатков, то на данном участке сформируется α-спираль. Валин, изолейцин, треонин, тирозин и фенилаланин способствуют образованию β-слоев полипептидной цепи. Неупорядоченные структуры возникают на участках полипептидной цепи, где сконцентрированы такие аминокислотные остатки, как глицин, серин, аспарагиновая кислота, аспарагин, пролин. Супервторичные структуры представляют собой энергетически предпочитаемые ансамбли вторичных структур – белковые домены. Домены обычно состоят из отрезков полипептидной цепи, содержащих от 50 до 350 аминокислот, и являются теми модульными единицами, из которых строятся белки. Небольшие белки могут содержать только один домен, более крупные белки состоят из нескольких доменов, связанных сравнительно открытыми участками полипептидной цепи (рис. 4). Каркас пространственной структуры подавляющего большинства доменов состоит из регулярных вторичных структур – a-спиралей и β-листов, которые стабилизованы регулярными водородными связями в главной цепи. В зависимости от наличия и расположения a- и β-структур, выделяют белки группы a-, b- и «смешанные» белки – a&b (рис. 5).
Рис. 5. Модели пространственной структуры некоторых белковых доменов: Третичная структура – трехмерная структура белка, характеризующаяся определенной укладкой в пространстве всех звеньев полипептидной цепи. Выделяют два общих типа третичной структуры белков: · Фибриллярные белки представляют собой нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых не имеют глобулярной формы, а вытянуты вдоль одной оси. Третичная структура представлена либо тройной a-спиралью, либо β-складчатыми структурами. Большинство фибриллярных белков выполняют структурные или защитные функции. Типичными фибриллярными белками являются a-кератин волос и шерсти, фиброин шелка и коллаген сухожилий. К этому классу относятся также нитевидные белки, присутствующие в сократительных системах мышечных и немышечных клеток, например актин и миозин, а также протофиламенты, из которых построены микротрубочки. · В глобулярных белках полипептидные цепи свернуты в плотную компактную структуру сферической (глобулярной) формы. Обычно третичную структуру белков рассматривают именно в отношении глобулярных белков, имеющих разнообразную пространственную организацию (нерегулярные участки, b-складчатые структуры, a-спирали) и более разнообразные функциональные возможности. Подавляющее большинство природных белков относится к глобулярным (почти все ферменты, транспортные белки крови, антитела, пищевые белки).
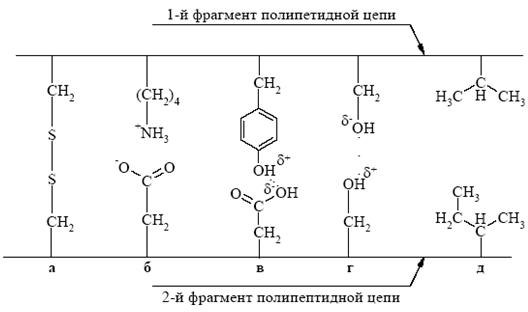
Кроме ковалентных связей, третичная структура белковой молекулы поддерживается слабыми взаимодействиями, которые, в свою очередь, разделяются на полярные и неполярные. К полярным взаимодействиям относятся ионные и водородные связи. Ионные взаимодействия образуются при контакте положительно заряженных групп боковых радикалов лизина, аргинина, гистидина и отрицательно заряженной СОО--группы аспарагиновой и глутаминовой кислот. Водородные связи возникают между функциональными группами боковых радикалов аминокислотных остатков. Гидрофобные взаимодействия между углеводородными радикалами аминокислотных остатков способствуют формированию гидрофобного ядра внутри белковой глобулы (рис. 6). Гидрофобные радикалы некоторых аминокислотных остатков избегают контактов с водным окружением и стремятся собраться вместе внутри глобулярной структуры, где они защищены от соприкосновения с водой. Границы между гидрофобным ядром и наружной поверхностью не всегда выражены, и часть гидрофобных радикалов может выступать на поверхность молекулы, что имеет особое значение для контакта между белковыми глобулами при образовании четвертичной структуры белков, а также для взаимодействия с другими внутриклеточными молекулами. Хотя нативная третичная структура каждого глобулярного белка отвечает минимуму свободной энергии и потому является самой устойчивой конформацией, какую может принять полипептидная цепь, третичная структура не является абсолютно жесткой и неподвижной. Многие глобулярные белки в норме претерпевают конформационные изменения при выполнении ими биологических функций. Например, молекула гемоглобина изменяет свою конформацию при связывании кислорода и возвращается к исходной конформации после его освобождения. Кроме того, молекулы многих ферментов претерпевают конформационные изменения при связывании субстратов – это составная часть их каталитического действия.
Рис. 6. Типы взаимодействий, поддерживающих третичную структуру белка:
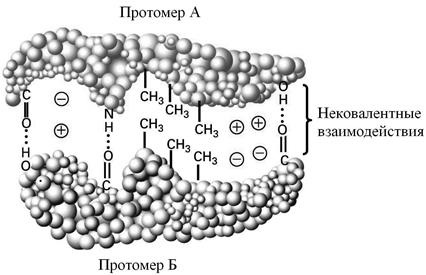
Четвертичная структура характерна для белков, построенных из нескольких полипептидных цепей. Полипептидные цепи занимают строго фиксированное положение друг относительно друга, вследствие чего белок обладает специфической функцией. Белок, имеющий четвертичную структуру, называется эпимолекулой или мультимером, а составляющие его отдельные полипептидные цепи – протомерами или субъединицами. Четвертичная структура поддерживается исключительно силами слабых взаимодействий (рис. 7), поэтому она представляет собой достаточно лабильное образование, значительно менее прочное, чем третичная или вторичная структуры. Участки субъединиц, на которых происходят взаимодействия, называются контактными площадками.
Рис. 7. Нековалентные (слабые) взаимодействия между протомерами белка
Белки, обладающие четвертичной структурой, как правило, содержат четное число субъединиц и представляют собой димеры, тетрамеры, гексамеры и т. д. Число димеров и тетрамеров резко преобладает среди всех изученных белков. Классическим примером белка, имеющего четвертичную структуру, является гемоглобин, молекула которого включает 4 субъединицы двух видов (a и b). Утрата или изменение структурной организации белковой молекулы называется денатурацией. Она сопровождается изменением свойств белка и происходит под воздействием различных физических и химических факторов (например, температуры, радиации, гормонов и др.). Если утрачена четвертичная, третичная или вторичная структуры, то возможно их восстановление, или ренатурация. Если же нарушения коснулись и первичной структуры, то ренатурация невозможна, и такая денатурация необратима.
|

 Протеиногенные аминокислоты являются α-аминокислотами (рис. 1) и имеют L-конфигурацию. Благодаря своему строению аминокислоты обладают амфотерными свойствами, т. е. одновременно проявляют свойства кислот и оснований. Аминогруппа сообщает молекуле аминокислоты свойства основания, карбоксильная группа – свойства кислоты. Недиссоциированная форма аминокислоты в нейтральном водном растворе превращается в диполярную форму (цвиттерион), которая способна взаимодействовать как с кислотами, так и с основаниями.
Протеиногенные аминокислоты являются α-аминокислотами (рис. 1) и имеют L-конфигурацию. Благодаря своему строению аминокислоты обладают амфотерными свойствами, т. е. одновременно проявляют свойства кислот и оснований. Аминогруппа сообщает молекуле аминокислоты свойства основания, карбоксильная группа – свойства кислоты. Недиссоциированная форма аминокислоты в нейтральном водном растворе превращается в диполярную форму (цвиттерион), которая способна взаимодействовать как с кислотами, так и с основаниями. пептидная группировка может существовать в двух резонансных формах (кето- и енольной):
пептидная группировка может существовать в двух резонансных формах (кето- и енольной): Эти свойства пептидной группировки определяют структуру полипептидной цепи, которая состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков – боковых радикалов аминокислотных остатков. Полипептидная цепь направленна, поскольку каждый из ее строительных блоков имеет разные концы: амино- и карбоксильную группы. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N -конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С -конец).
Эти свойства пептидной группировки определяют структуру полипептидной цепи, которая состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков – боковых радикалов аминокислотных остатков. Полипептидная цепь направленна, поскольку каждый из ее строительных блоков имеет разные концы: амино- и карбоксильную группы. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N -конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С -конец). α-спираль (рис. 3а). Остов полипептидной цепи закручивается в спираль, при этом радикалы аминокислот обращены кнаружи от спирали. Фиксируется α-спираль водородными связями, которые расположены параллельно оси спирали и многократно повторяются. В силу этого α-спираль имеет плотно упакованную структуру, не имеющую внутреннего канала и не проницаемую даже для молекул воды. α-спираль имеет определенные характеристики: радиус – 0,23 нм, расстояние между витками – 0,54 нм, среднее число аминокислотных остатков, приходящееся на один оборот, – 3,6. В природных белках существуют только правозакрученные α-спирали, что связано с наличием в них аминокислот L-ряда.
α-спираль (рис. 3а). Остов полипептидной цепи закручивается в спираль, при этом радикалы аминокислот обращены кнаружи от спирали. Фиксируется α-спираль водородными связями, которые расположены параллельно оси спирали и многократно повторяются. В силу этого α-спираль имеет плотно упакованную структуру, не имеющую внутреннего канала и не проницаемую даже для молекул воды. α-спираль имеет определенные характеристики: радиус – 0,23 нм, расстояние между витками – 0,54 нм, среднее число аминокислотных остатков, приходящееся на один оборот, – 3,6. В природных белках существуют только правозакрученные α-спирали, что связано с наличием в них аминокислот L-ряда. Нерегулярная структура –тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет постоянного характера, поэтому нерегулярные структуры могут иметь различную конформацию (рис. 4). Один из видов такого рода структур получил название β-изгиб. Этот элемент наблюдается при изменении направления полипептидной цепи на 1800 и стабилизируется водородной связью между 1-м и 4-м по ходу цепи аминокислотными остатками.
Нерегулярная структура –тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет постоянного характера, поэтому нерегулярные структуры могут иметь различную конформацию (рис. 4). Один из видов такого рода структур получил название β-изгиб. Этот элемент наблюдается при изменении направления полипептидной цепи на 1800 и стабилизируется водородной связью между 1-м и 4-м по ходу цепи аминокислотными остатками.

 Третичную структуру белка стабилизируют взаимодействия, возникающие между боковыми радикалами аминокислотных остатков разных участков полипептидной цепи. Эти взаимодействия можно разделить на сильные и слабые. К сильным взаимодействиям относятся ковалентные связи между атомами серы остатков цистеина, стоящих в разных участках полипептидной цепи. Такие связи называются дисульфидными мостиками:
Третичную структуру белка стабилизируют взаимодействия, возникающие между боковыми радикалами аминокислотных остатков разных участков полипептидной цепи. Эти взаимодействия можно разделить на сильные и слабые. К сильным взаимодействиям относятся ковалентные связи между атомами серы остатков цистеина, стоящих в разных участках полипептидной цепи. Такие связи называются дисульфидными мостиками: