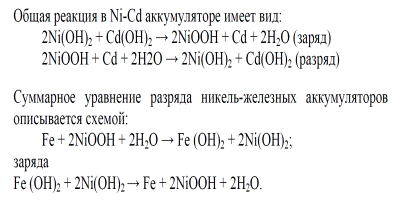Классификация дисперсных систем по агрегатным состояниям фаз.
33. классификация растворов. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми. Твердые – сплав золота и меди Жидкие – раствор поваренной соли в воде Газообразные – воздух – газообразный раствор кислорода, азота, диоксида углерода и других газов. 34. Твердые растворы. Классификация. Твёрдые растворы — фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решётке. Различают три вида твёрдых растворов: 1) твёрдые растворы замещения; (В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента. Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.) 2) твёрдые растворы внедрения; (Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя. Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры. 3) твёрдые растворы вычитания. (Твердые растворы вычитания или растворы с дефектной решеткой. Образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке.) 35. Способы выражения состава растворов. Массовая доля – отношение массы растворенного вещества к массе раствора ω(в-ва) = m(в-ва)/m(р-ра) Объемная доля – отношение объема вещества к объему раствора φ = V(вещества)/V(раствора) Мольная доля – отношение количества вещества в сумме количеств вещества и растворителя χ(в-ва) = n(в-ва)/(n(в-ва)+n(р-ра)) моляльность – отношение количества вещества к массе растворителя B(в-ва) = n(в-ва)/m(р-ля) (моль/кг) Титр – масса растворенного в-ва в 1 мл раствора Т(в-ва) = m(в-ва)/V(р-ра) (г/мл)= (г/см3) Молярность / Молярная концентрация – отношение количества растворенного вещества к объему раствора С(в-ва), М = n(в-ва)/V(р-ра) (моль/л)= [М] Нормальность/ Нормальная концентрация Н= n(экв. в-ва)/ V(р-ра) (моль/л)= [Н] Сн= э* См.
36. Механизм образования жидких растворов. Сольватация и гидратация. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространеным растворителем из неорганических веществ, конечно же, является вода, в органических веществах в качестве растворителей используют диэтиловый эфир, ацетон, бензол, четыреххлористый углерод др. В процессе растворения частицы (ионы или молекулы) растворяемо вещества под действием хаотически движущихся частиц переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образовнию растворов выражена у разных веществ в различной степени. Но вещества способны смешиваться друг с другом в любых количествах. Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией. Гидратация (от др.-греч. ὕδωρ — вода) — присоединение молекул воды к молекулам или ионам. Гидратация является частным случаем сольватации — присоединения к молекулам или ионам веществ молекул органического растворителя. 37. Автопротолиз воды. Водородный показатель. Кислотность среды. Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов. Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН. Кислотность (лат. aciditas) — характеристика активности ионов водорода в растворах и жидкостях. ?-38. Коллоидные системы. Причины их возниновения. Компоненты коллоидной частицы. Коллоидные системы, коллоиды — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — смесь веществ, в которых дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 100 нм, распределены в дисперсионной среде, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок. 39-? 40. Гидролиз солей. Виды гидролиза. Пояснить на конкретном примере. Гидролизом соли называется взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и, как следствие этого, к изменению рН среды.
Na2SO3= 2Na+ + SO32- Na+ + H2O не пойдет, так как сильная частица 1 ст. SO32- + H+ -OH- = HSO3- + OH- щелочная среда Na2SO3 + H2O= NaHSO3 + NaOH 2 ст. HSO3- + H+-OH- = H2SO3 + OH- NaHSO3 + H2O= H2SO3 + NaOH 41. ОВР Окисли́тельно-восстанови́тельные реа́кции, также редокс — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Окислитель - атомы, молекулы или ионы, принимающие электроны
42. Окисление и восстановление. Окислители и восстановители. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Окислитель - атомы, молекулы или ионы, принимающие электроны 43. Степень окисления, правила для определения степени окисления. Степень окисления- условный заряд атома в молекуле, вычисленный исходя из предположния, что молекула состоит только из ионов. 1. Степень окисления любого элемента в простом веществе равна 0 (О2, Р4) 2. Алюминий имеет в соединениях степень окисления +3. 3. Степень окисления атомов в одноатомных ионах, непример Mg2+, S2-, совпадает с зарядом этих ионов. 4. Щелочные и щелочноземельные металлы в своих соединениях (NaF, BaCl2) всегда проявляют степень окисления +1 и +2 5. Фтор во всех своих соединениях проявляет степень окисления –I 6. Кислород во всех соединениях (кроме OF2 и пероксидов) проявляет степень окисления -2. В соединении OF2 степень оксления кислорода +2, а в соединениях типа K2O2 (пероксид калия) степень окисления кислорода равна -1. 7. Степень окисления водорода, связанного с атомами более электроотрицательных элементов, равна +1, а в солеобразных гидридах (соед.с активными металлами, например NaH, CaH2, KH) степень окисления водорода равна -1. 8. В молекуле алгебраическая сумма значений степени окисления всех образующих ее атомов равна нулю, а в многоатомном ионе- заряду этого иона. 44. Классификация ОВР(привести примеры) 1) Реакци межатомного и межмолекулярного икисления-восстановления 2) Реакции внутримолекулярного окисления-восстановления 3) Реакции диспропорционирования (самоокисления- самовосстановления) 1: Н2S + Cl2 → S + 2HCl 2: 2H2O → 2H2 + O2 3: Cl2 + H2O → HClO + HCl 45. Виды первычных источников тока. Первичные и. т. (гальванические элементы и батареи) допускают, как правило, однократное использование энергии химических реагентов. Отдельные конструкции гальванических элементов и батарей разрешают кратковременное повторное использование энергии реагентов после электрической подзарядки. Положительный (катод) и отрицательный (анод) электроды, разделённые электролитом в жидком или пастообразном состоянии или же пористой мембраной-сепаратором с поглощённым в ней электролитом, электрически связаны (гальваническая связь) в течение всего срока службы и. т. 46. Вторичные И. т. (отдельные Аккумуляторы и аккумуляторные батареи) допускают многократное (сотни и тысячи заряд-разрядных циклов) использование энергии составляющих химических реагентов. Электроды и электролит весь срок службы аккумуляторов находятся в электрическом контакте друг с другом. Для увеличения ресурса аккумуляторов в некоторых специфических условиях эксплуатации разработаны способы сухозаряженного хранения аккумуляторов. Такие аккумуляторы перед включением предварительно заливают электролитом.
47. Устройство литиевого аккумулятора. Литий-ионный аккумулятор состоит из электродов (катодного материала на алюминиевой фольге и анодного материала на медной фольге), разделенных пропитанными электролитом пористыми сепараторами. Пакет электродов помещен в герметичный корпус, катоды и аноды подсоединены к клеммам-токосъемникам. Корпус имеет предохранительный клапан, сбрасывающий внутреннее давление при аварийных ситуациях и нарушении условий эксплуатации. Литий-ионные аккумуляторы различаются по типу используемого катодного материала. Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который имеет способность внедряться (интеркалироваться) в кристаллическую решетку других материалов (например, в графит, окислы и соли металлов) с образованием химической связи, например: в графит с образованием LiC6, окислы (LiMO2) и соли (LiMRON) металлов. При заряде Li-ion аккумулятора происходят реакции: на положительных пластинах: LiCoO2 → Li1-nCoO2 + nLi+ + ne– на отрицательных пластинах: С + nLi+ + ne– → CLin 48. Устройство свинцово- кислотного аккумулятора. Элемент свинцово-кислотного аккумулятора состоит из электродов (положительных и отрицательных) и разделительных изоляторов (сепараторов), которые погружены в электролит. Электроды представляют собой свинцовые решётки. У положительных активным веществом является диоксид свинца (PbO2), у отрицательных активным веществом является губчатый свинец. Электроды погружены в электролит, состоящий из разбавленной дистиллированной водой серной кислоты (H2SO4). Наибольшая проводимость этого раствора наблюдается при комнатной температуре (что означает наименьшее внутреннее сопротивление и наименьшие внутренние потери) и при его плотности 1,23 г/см³ 49. Химические процессы, протекающие в свинцово-кислотных аккумуляторах.
50. Классификация никилевых аккумуляторов. 1. Щелочные никилиевые (никель- кадмиевые, никель- железные, никель- водородные) 2. Никель- металлогидридные. 51. Химические процессы, протекающие в никелевых аккумуляторах.
52. Устройство никель- железного аккумулятора, его значение.
|