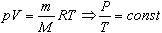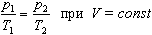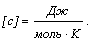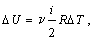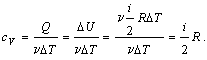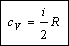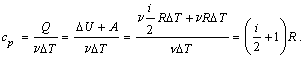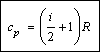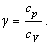Пусть идеальный газ изобарически переходит из 1-го состояния во 2-е. Давление в обоих состояниях одинаково, обозначим его p. Для любого состояния справедливо уравнение Клапейрона-Менделеева, поэтому можем записать:
p1V1 = 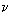 RT1 и p2V2 =
RT1 и p2V2 = 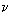 RT2.
RT2.
Найдем работу газа:
A = p 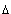 V = p(V2 – V1) = pV2 – pV1.
V = p(V2 – V1) = pV2 – pV1.
Подставим соотношения, полученные выше, тогда:
A = 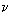 RT2 –
RT2 – 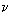 RT1 =
RT1 = 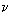 R(T2 – T1).
R(T2 – T1).
В скобках стоит изменение температуры, поэтому окончательно получаем:
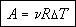
Если имеется один моль газа, а изменение температуры составляет 1 К, то работа равна молярной газовой постоянной.
Молярная газовая постоянная численно равна работе, совершаемой одним молем идеального газа при его изобарическом нагревании на 1 К.
5. Внутренняя энергия газа. В газах взаимодействием молекул друг с другом можно пренебречь, поэтому внутренняя энергия газа определяется только суммой кинетической энергии всех его молекул.
Если известна средняя кинетическая энергия молекул 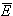 , то внутренняя энергия газа, содержащего N молекул равна:
, то внутренняя энергия газа, содержащего N молекул равна:
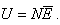
Среднюю кинетическую энергию молекул можно найти, используя формулу, предложенную Больцманом:
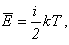
а число молекул выразить через количество вещества:
N = 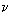 NА.
NА.
Тогда имеем:
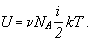
Учитывая, что произведение числа Авогадро на постоянную Больцмана равно молярной газовой постоянной, получаем в окончательном виде формулу для определения внутренней энергии газа:
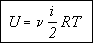
6. Первое начало термодинамики. Сформулируем закон сохранения и превращения энергии применительно к тепловым процессам.
Подведенная к термодинамической системе теплота расходуется на изменение внутренней энергии и совершение работы.
Это утверждение называется первым началом термодинамики. Его можно записать в виде формулы:
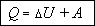
В зависимости от того какой именно процесс совершается над газом, одно из слагаемых в этом выражении может обращаться в нуль.
1) Изобарический процесс (p = const).
И внутренняя энергия изменяется, и работа совершается, поэтому:
Q = 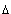 U + A.
U + A.
2) Изохорический процесс (V = const).
Поскольку расширение газа отсутствует, то работа равна нулю, поэтому:
Q = 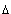 U.
U.
Таким образом, газ в данном случае ведет себя при нагревании как твердое тело или жидкость.
3) Изотермический процесс (T = const).
Поскольку температура неизменна, то нет и изменения внутренней энергии, поэтому:
Q = A.
В данном случае вся подведенная теплота расходуется на совершение работы.
7. Адиабатный процесс.
Процесс, происходящий без обмена теплом с окружающей средой, называется адиабатным.
В чистом виде адиабатные процессы встречаются редко, однако, множество быстрых процессов, при которых теплобмен с окружающей средой просто не успевает произойти, близки к адиабатным.
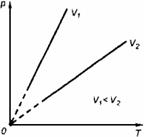
Сравним свойства изотермического процесса и адиабатного.
|
| Изотермический процесс
| Адиабатный процесс
|
| Отличительный признак
| T = const
| Q = 0
|
| График
| Кривая 1 (гипербола) на рис. 4.4
| Кривая 2 (политропа) на рис. 4.4
|
| Уравнение
| Закон Бойля-Мариотта 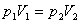
| Уравнение Пуассона 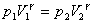
|
| I-е начало термодинамики
| Q = A
| A = – 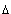 U U
|
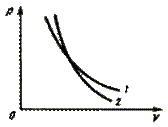 Рис. 4.4. Рис. 4.4.
|
В уравнении Пуассона присутствует 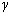 – показатель политропы, который следует брать равным 5/3, 7/5 и 4/3 соответственно для одноатомных, двухатомных и многоатомных газов.
– показатель политропы, который следует брать равным 5/3, 7/5 и 4/3 соответственно для одноатомных, двухатомных и многоатомных газов.
При адиаба УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Пусть газ массой m занимает объем V при температуре Т и давлении р, а М - молярная масса газа. По определению, концентрация молекул газа: n = N/V, где N -число молекул.
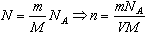
Подставим это выражение в основное уравнение молекулярно-кинетической теории:
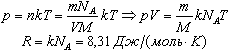
Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде
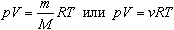
называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия - давление газа равно атмосферному (р = 101,325 кПа) при температуре таяния льда (Т = 273,15 К).
1. Изотермический процесс
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Если Т =const, то
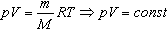
Закон Бойля-Мариотта
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p1V1=p2V2 при Т = const
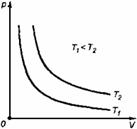
График процесса, происходящего при постоянной температуре, называется изотермой.
2. Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
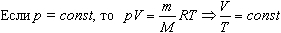
Закон Гей-Люссака
Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре:
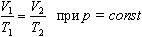
Если газ, имея объем V0 находится при нормальных условиях: 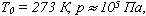 а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
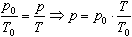
Обозначив
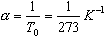
получим V=V0  T
T
Коэффициент  называют температурным коэффициентом объемного расширения газов. График процесса, происходящего при постоянном давлении, называется изобарой.
называют температурным коэффициентом объемного расширения газов. График процесса, происходящего при постоянном давлении, называется изобарой.
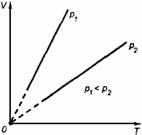
3. Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Ecли V = const, то
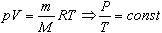
Закон Шарля
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре:
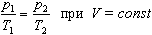
Если газ, имея объем V0,находится при нормальных условиях:
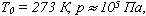
а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р, то можно записать
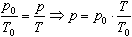
График процесса, происходящего при постоянном объеме, называется изохорой.
тном процессе работа совершается только за счет изменения внутренней энергии.
8. Теплоемкость газа.
Количество теплоты, расходуемое на нагревание газа, прямо пропорционально количеству вещества и изменению температуры:
Q = c 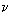
 T.
T.
Молярная теплоемкость газа измеряется количеством теплоты, необходимым для нагревания 1 моля газа на 1 K.
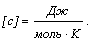
Молярная теплоемкость газа зависит от совершаемого над ним процесса.
1) Изохорический процесс (V = const).
Первое начало термодинамики для этого процесса имеет вид:
Q = 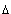 U.
U.
Используя формулу, полученную выше, выражаем изменение внутренней энергии газа:
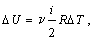
вычисляем теплоемкость:
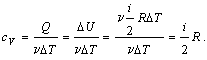
Таким образом, молярная теплоемкость при постоянном объеме равна:
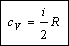
2) Изобарический процесс (p = const).
Первое начало термодинамики для этого процесса имеет вид:
Q = 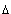 U +
U + 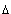 T.
T.
Используя формулы, полученные выше, выражаем изменение внутренней энергии газа:
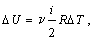
работу газа:
A = 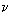 R
R 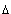 T,
T,
вычисляем теплоемкость:
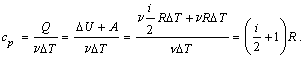
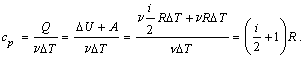
Таким образом, молярная теплоемкость при постоянном давлении равна:
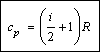
Учитывая выражение для молярной теплоемкости при постоянном объеме, можно также записать:
cp = сV + R.
3) Изотермический процесс (T = const).
Поскольку температура неизменна, то 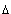 T = 0, а теплоемкость газа равна бесконечности.
T = 0, а теплоемкость газа равна бесконечности.
4) Адиабатный процесс (Q = 0).
Теплоемкость газа равна нулю.
Показатель политропы 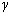 , входящий в уравнение Пуассона, выражается через молярные теплоемкости газа при постоянном давлении и постоянном объеме:
, входящий в уравнение Пуассона, выражается через молярные теплоемкости газа при постоянном давлении и постоянном объеме:
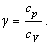

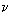 RT1 и p2V2 =
RT1 и p2V2 = 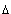 V = p(V2 – V1) = pV2 – pV1.
V = p(V2 – V1) = pV2 – pV1. 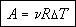
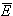 , то внутренняя энергия газа, содержащего N молекул равна:
, то внутренняя энергия газа, содержащего N молекул равна: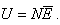
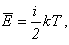
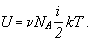
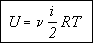
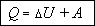
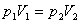
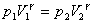
 Рис. 4.4.
Рис. 4.4.
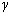 – показатель политропы, который следует брать равным 5/3, 7/5 и 4/3 соответственно для одноатомных, двухатомных и многоатомных газов.
– показатель политропы, который следует брать равным 5/3, 7/5 и 4/3 соответственно для одноатомных, двухатомных и многоатомных газов.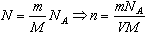
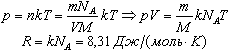
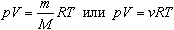
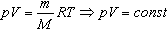

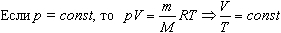
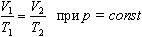
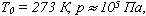 а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать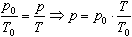
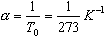
 T
T