Катализ и катализаторы- определение, сущность катализа, классификация. Примеры каталитических реакций. Роль катализа в современной промышленности.
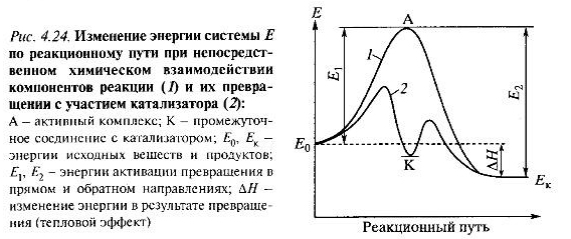
Катализ- явление возбуждения хим.реакций веществами- катализаторами. Катализатор многократно вступает в промежуточное хим. взаимодействие с участниками реакции и восстанавливает свой состав после каждого цикла промежуточного взаимодействия.
Основные понятия кинетики- элементарная стадия, механизм, маршрут, брутто-реакция, скорости реакции и превращения, кинетическая модель. Стадия гетерогенного катализа - Сложная гетерогенно-каталитич. р-ция протекает через последовательность стадий, традиционно считавшихся элементарными: подвод реагентов из объемной фазы к пов-сти катализатора (диффузия), адсорбция, хим. превращение на пов-сти (собственно катализ), десорбция продуктов, их отвод от пов-сти катализатора (диффузия). Исходными в-вами, реагирующими в элементарных р-циях, по определению, являются промежут. в-ва, к-рые образуются в предшествующих стадиях и не м. б. выделены вместе с реагирующими в-вами или продуктами р-ции.
Путь химической реакции называют механизмом. Это понятие подразумеваетзнание всех этапов превращения из исходных соединений в конечные, природы всехпромежуточных соединений, распределения энергии для всех участников реакции,влияния условий проведения превращения, а в гетерогенной кинетике и свойствповерхности, характера адсорбции реагентов и продуктов, процессов тепло – и массопереноса. Но чащепользуются понятием скорость химической реакции, определяемой как число частиц,превращающихся или образующихся в реакции, в единицу времени в единице объемареакционного пространства, V. Скорость превращения: изменение степени полноты реакции или химической переменной во времени: d ξ / dt {моль/с}. 3.Основы теории мтационарных скоростей реакции.Пример её исполь3ования при построении кинетической модели каталитической реакции. В теории стационарных реакций (и основанном на ней методе маршрутов, развитом Темкиным и Хориути) существенно понятие «скорость по базисному маршруту». Вначале определяется число пробегов как число элементарных актов в прямом (и обратном) направлении. Если число пробегов каждой стадии равно ее стехиометрическому числу для данного базисного маршрута, то пробег реакции осуществляется по этому маршруту, в результате чего число молекул — участников реакции — меняется в соответствии с итоговым уравнением маршрута. Скорость реакции по базисному маршруту равна числу пробегов по нему в единице реакционного пространства и составляет лишь часть скорости элементарной стадии, «обслуживающей» этот маршрут. В итоге скорость каждой стадии представляется как линейная комбинация скоростей по базисным маршрутам.
|