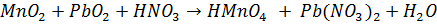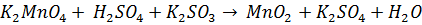Соединения марганца (II, IV, VI, VII).
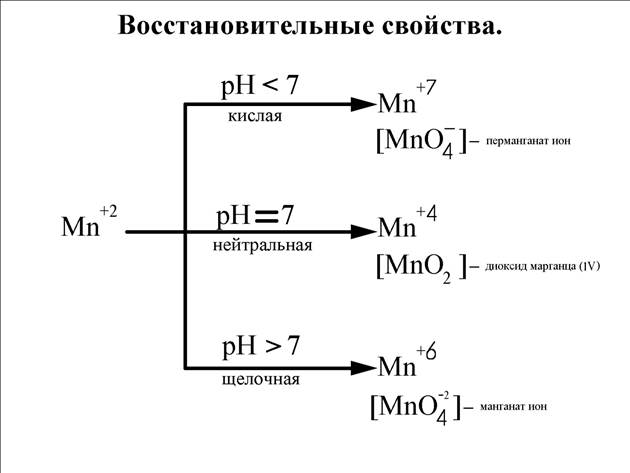
Окислительно-восстановительные свойства соединений Mn.
С повышением кислотности среды восстановительная способность марганца возрастает.
Соединения Tc (ll) и Re (ll) не характерны Окислительные свойства(+7):
Окислительная способность выше в кислой среде.
Соединения +4.
Соединения Mn (lV) сильные окислители.
Соединения +6. - с водой: - в кислой среде: - с хлором: Производные Tc (Vl) и Re (Vl) легко окисляются даже молекулярным кислородом:
Технеций.
степени окисления: +2, +3, +4, +5, +6, +7 На Земле встречается в следовых количествах в урановых рудах, 5·10−10 г на 1 кг урана. Получение: Технеций получают из радиоактивных отходов химическим способом. Кроме того, технеций образуется при делении нуклидов 232Th, 233U, 238U, 239Pu и может накапливаться в реакторах килограммами за год. Свойства: Технеций — радиоактивный переходный металл серебристо-серого цвета. По химическим свойствам технеций близок к марганцу и рению. При взаимодействии с кислородом образует оксиды Tc2O7 и TcO2, с хлором и фтором — галогениды TcX6, TcX5, TcX4, с серой — сульфиды Tc2S7 и TcS2. В ряду напряжений технеций стоит правее водорода, не реагирует с соляной, но легко растворяется в азотной и серной кислотах.
Рений.
степени окисления: +2, +3, +4, +5, +6, +7 Рений встречается в виде редкого минерала джезказганита (CuReS4), найденного вблизи казахстанского города Джезказган(современное название — Жезказган). Кроме того, в качестве примеси рений входит в колумбит, колчедан, а также в циркон и минералы редкоземельных элементов. Получение: Рений получают при переработке сырья с очень низким содержанием целевого компонента (в основном это медное и молибденовое сульфидное сырье). Переработка сульфидного рений содержащего медного и молибденового сырья основана на пирометаллургических процессах (плавка, конвертирование, окислительный обжиг). В условиях высоких температур рений возгоняется в виде высшего оксида Re2O7, который затем задерживается в системах пылегазоулавливания. В случае неполной возгонки рения при обжиге молибденитовых концентратов, часть его остается в огарке и затем переходит в аммиачные или содовые растворы выщелачивания огарков (NH4ReO4), которые позже восстанавливают водородом: 2NH4ReO4 + 4H2 → N2 + 2Re + 8H2O. Полученный порошок рения методами порошковой металлургии превращают в слитки металла. Свойства: Физические свойства Рений — тугоплавкий тяжёлый металл, по внешнему виду напоминает сталь. Порошок металла — чёрного или темно-серого цвета в зависимости от дисперсности. По ряду физических свойств рений приближается к тугоплавким металлам VI группы (молибден, вольфрам), а также к металлам платиновой группы. По температуре плавления рений занимает второе место среди металлов, уступая лишь вольфраму, а по плотности — четвёртое (после осмия, иридия и платины). Химические свойства Компактный рений устойчив на воздухе при обычных температурах. При температурах выше 300°C наблюдается окисление металла, интенсивно окисление идет при температурах выше 600°C. Рений более устойчив к окислению, чем вольфрам, не реагирует непосредственно с азотом и водородом; порошок рения лишь адсорбирует водород. При нагревании рений взаимодействует с фтором, хлором и бромом. Рений почти не растворим в соляной и плавиковой кислотах и лишь слабо реагирует с серной кислотой даже при нагревании, но легко растворяется в азотной кислоте. Со ртутью рений образует амальгаму. Рений взаимодействует с водными растворами пероксида водорода с образованием рениевой кислоты.
|

 - восстановительные свойства
- восстановительные свойства - и окислительные, и восстановительные
- и окислительные, и восстановительные - и окислительные, и восстановительные
- и окислительные, и восстановительные - окислительные свойства
- окислительные свойства