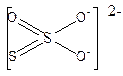Группа анионов.
Реакции аниона SO42-. В водных растворах диссоциация серной кислоты по первой ступени протекает полностью, по второй – частично (рКа, 2=1,92). Большинство сульфатов и гидросульфатов хорошо растворимы в воде, причем, гидросульфаты растворимы лучше. Малорастворимы сульфаты свинца, бария, стронция, кальция, серебра и ртути(I). 1. Реакция с хлоридом бария. а) Ва2+ с сульфат-ионом образует белый кристаллический осадок, практически нерастворимый в воде (ПРВаSO4=1,1·10-10) и кислотах: Ba2+ + SO42- = ↓BaSO4 Последним свойством BaSO4 отличается от солей бария других анионов, чем пользуются при дробном открытии SO42-. Реакции мешают S2O32- и смесь SO32- и S2-. Так как при подкислении выделяется осадок серы, который можно принять за сульфат бария, так как он тоже нерастворим в кислотах: S2O32- + 2H+ = ↓S + SO2 + H2O SO32- + 2S2- + 6H+ = ↓ 3S + 3H2O Сульфат бария растворим в растворе ЭДТА. Выполнение реакции. К нескольким каплям раствора, содержащегоSO42-, подкисленного несколькими каплями раствора НСl добавить равный объём хлорида бария. Наблюдать образование осадка. б) В присутствии КМnO4 сульфат-ион образует изоморфные кристаллы (ВаSO4 и KMnO4) розоватого цвета. При добавлении восстановителей (Н2С2О4, Н2О2) раствор обесцвечивается, осадок остается окрашенным. Если к раствору с осадком добавить 3-5 капель эфира, осадок флотируется на границе раздела фаз. Мешают все серосодержащие анионы, так как подвергаются окислению перманганатом калия. Выполнение реакции. К нескольким каплям подкисленного серной кислотой раствора, содержащего SO42- добавить равный объём разбавленного раствора КМnO4 (бледно-розовый цвет) и 2-3 капли раствора ВаСl2. Нагреть, добавить несколько капель 3% раствора Н2О2. Что наблюдается? Записать уравнение реакций.
Реакции аниона SO3 2- SO32- - ион является анионом слабой сернистой кислоты /рКа,I = 1,89, рКа,2 = 7,17/. В виде молекул H2SO3 существует в растворах в очень малых количествах. В водных растворах в очень малых количествах. В водных растворах возможны следующие равновесия: SO2 + xH2O = SO2·xH2O SO2 + H2O = H2SO3 (Kp<<1) SO2·xH2O = HSO3- + H3O+ + (x-2)H2O При нагревании все равновесия смещаются влево, при кипячении можно полностью удалить SO2. При охлаждении выделяется осадок кристаллогидрата SO2·7H2O. В воде растворимы только сульфиты щелочных металлов и аммония. SO32- - ион в водных растворах постепенно окисляется до SO42-. 1. Реакция с хлоридом бария. Барий с сульфит – ионом образует белый осадок, растворимый в кислотах: Ba2+ + SO32- = BaSO3↓ BaSO3↓ + 2H+ == Ba2+ + H2O + SO2↑ Выполнение реакции. К 2-3 каплям раствора, содержащего SO32-, добавить 2-3 капли раствора BaCI2. Что образуется? Как действуют минеральные кислоты на осадок? 2. Реакция с минеральными кислотами. HCI, H2SO4 и другие разлагают сульфиты с выделением SO2, который является восстановителем и обесцвечивает растворы I2 и KMnO4: SO2 + I2 + 2H2O = SO42- + 2I- + 4H+ 5SO2 + 2MnO4- + 2H2O = 5SO42- + 2Mn2+ + 4H+ Мешают анионы S2O32- и S2-. При подкислении раствора тиосульфата выделяется SO2, сульфида – Н2S, также обесцвечивающие растворы окислителей. Выполнение реакции. К нескольким каплям сульфита натрия прибавить равный объем раствора H2SO4 и 1-2 капли раствора KMnO4. Подогреть. Что наблюдается? Вместо KMnO4 можно использовать раствор I2, к которому добавлено несколько капель крахмала.
Реакции аниона S2O32- S2O32- ион является анионом тиосерной кислоты. Это неустойчивая кислота, в водном растворе разлагается с выделением SO2. Графически строение аниона можно представить следующим образом:
Хорошо растворимы соли щелочных металлов, стронция, цинка, кадмия, никеля, кобальта, марганца и железа(II). Малорастворимые тиосульфаты, например серебра, меди, ртути(II), бария и некоторые другие в водных растворах переходят в сульфиды.
Ва2+ + S2O32- = ↓Ва S2O3 заметно растворимый при нагревании. При растворении в минеральных кислотах осадок разлагается, выделяя серу. Выполнение реакции. Получить осадок тиосульфата бария. Проверить его отношение к нагреванию, кислотам.
↓Аg2S2O3 + н2о = ↓Аg2S + Н2SO4 Нагревание ускоряет этот процесс. При действии НNО3 и нагревании происходит растворение сульфида серебра: ↓3Аg2S + 8HNO3 = 6AgNO3 + ↓3S + 2NO↑ + 4H2O При большой концентрации S2O32- возможно образование комплексных анионов Аg S2O3-, [Аg (S2O3)2]3-, [Аg (S2O3)3]5-, в равновесии с ними могут находиться двух- и полиядерные анионы типа [Аg2(S2O3)3]4-, [Аg 6(S2O3)8]10-; поэтому не надо брать избыток S2O32- - ионов. Обнаружению тиосульфат ионов мешает S2- солями кадмия в нейтральной среде или солями свинца в уксуснокислой среде. Выполнение реакции. Приготовить раствор Nа2S2O3 в пробирке из нескольких кристалликов вещества и примерно 1мл воды, добавить 3-5 капель раствора AgNO3, нагреть, перемешать. Наблюдать изменение цвета. Записать уравнения реакций. 3. Реакция с минеральными кислотами. Кислоты разлагают тиосульфаты с выделением тиосерной кислоты по уравнению: S2O32- + 2H+ = H2S2O3 H2S2O3 = H2O + ↓3S + SO2↑ Этой реакции мешает сочетание ионов SO32- S2-, так как при подкислении происходит их взаимодействие: H2S2O3 = H2O + ↓S + 3H2O Выполнение реакции. К нескольким каплям раствора, содержащего S2O32- -ионов до тетратионат-ионов по уравнению: 2S2O32- + I2 = S4O62- + 2I- В щелочном растворе йод диспропорционирует на йодид и йодноватистую кислоту: I2 + OH- = I- + HIO HIO окисляет S2O32- до SO42-:
4HIO + S2O32- + 6OH- = 4I- + 2SO42- + 5H2O Обнаружению мешают SO32- и S2-. Выполнение реакции. К 3-5 каплям раствора йода добавить 1 каплю крахмала, 5-7 капель раствора тиосульфата натрия. Что наблюдается?
Реакции аниона СО32-. Соответствующая карбонат-иону угольная кислота является очень слабой кислотой (рКа,1=6,35, рКа,2=10,30) и существует только в водном растворе. Насыщенный водный раствор при18 0С и атмосферном давлении является примерно 0,04М относительно СО2. В водном растворе имеют место следующие равновесия: Н2О + СО2 = Н2СО3 = Н+ + НСО3- = 2Н+ + СО32- Из солей в воде растворимы карбонаты щелочных металлов и аммония (за исключением LiCO3) и гидрокарбонаты щелочных и щелочноземельных металлов. Малорастворимые соли легко растворяются в уксусной и минеральных кислотах. Соли угольной кислоты сильно гидролизуются и их водные растворы имеют щелочную реакцию. 1. Реакция с хлоридом бария. ВаСl2 с растворимыми карбонатами образует на холоду белый аморфный осадок карбоната бария, который постепенно при стоянии переходит в кристаллическую форму. Выполнение реакции. Получить осадок карбоната бария, разделить на две пробирки и испытать действие растворов уксусной и соляной кислот. Записать уравнение реакций. 2. Реакция с кислотами. Кислоты, в том числе и СН3СООН, разлагают карбонаты с выделением СО2: 2Н+ + СО32- = Н2О + СО2↑, Который обнаруживают по помутнению известковой или баритовой воды. СО2 + Са(ОН)2 = ↓СаСО3 + Н2О СО2 + Ва(ОН)2 = ↓ВаСО3 + Н2О При длительном пропусконии углекислого газа осадок растворяется: ↓СаСО3 + СО2 + Н2О =Са2+ + 2НСО3- Обнаружению мешают ионы SO32- и S2O32-, так как SO2, образующийся при подкислении раствора, также образует белые осадки Са SO3 и Ва SO3. Поэтому перед открытием карбонат-иона надо предварительно окислить SO32- и S2O32- до SO42- пероксидом водорода при нагревании в течение 2-3 минут. Выполнение реакции. В пробирку с 1 мл раствора BaCO3 внести равный объём раствора НСl. Закрыть газоотводной трубкой и выделяющийся при нагревании СО2 пропускать в раствор известковой воды. Что наблюдается? Продолжить пропускать СО2. Описать наблюдаемые явления.
Реакции аниона РО4 3- РО43- - анион является анионом трёхосновной фосфорной кислоты (рКа,1=2,15, рКа,2=7,21, рКа,3 = 12,33). То есть, по первой ступени диссоциации это кислота средней силы, по второй и третьей – слабая. В воде растворимы все фосфаты щелочных металлов (кроме Li3РО43-) и аммония, а также дигидрофосфаты
|