Коррозия металлов в растворах электролитов при различных значениях рН
Коррозия металлов в средах, имеющих ионную проводимость, протекает через стадию анодного окисления металла Ме В зависимости от активности металлов и от рН среды наиболее вероятна реализация одного из двух видов катодного процесса. 1. Восстановление ионов водорода и выделение Н2 на катодных участках: (+) К: 2Н+ + 2 Протекание этого процесса возможно, если E Коррозия металлов, при которой катодная реакция осуществляется с выделением водорода, называется коррозией металлов с водородной деполяризацией. Равновесный потенциал водородного электрода, вычисленный по уравнению Нернста при парциальном давлении водорода p Значения равновесного потенциала водородного электрода в зависимости от рН для парциального давления водорода Таблица 10.1 Равновесный потенциал водородного электрода при 25 оС в зависимости от рН среды
В нейтральной среде при отсутствии кислорода все металлы, имеющие электродный потенциал более отрицательный, чем −0,415 В будут восстанавливать водород из воды: (+) К: 2Н2О + 2 В щелочной среде коррозии подвергаются только щелочные и щелочноземельные металлы, а также алюминий и марганец. 2. Восстановление кислорода О2: в нейтральной или щелочной среде (+) К: О2 + 2Н2О + 4 в кислой среде (рН< 7) (+) К: О2 + 4Н+ + 4 Равновесный потенциал кислородного электрода, вычисленный по уравнению Нернста при парциальном давлении водорода p Процессы коррозии металлов, у которых катодная реакция осуществляется с участием растворенного в электролите кислорода, называется коррозией с кислородной деполяризацией. С кислородной деполяризацией корродируют металлы, находящиеся в атмосфере или соприкасающиеся с водой и растворами солей. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом. В табл. 10.2 приведены зависимости значений равновесного потенциала кислородного электрода от рН. Таблица 10.2 Равновесный потенциал кислородного электрода при 25 оС в зависимости от рН среды
В качестве примера рассмотрим процесс коррозии стали (сталь – сплав на основе железа с содержанием углерода от 0,02 до 2,06 %). Роль анода играют структурные составляющие сплава, обладающие отрицательным электродным потенциалом (например, зерна феррита – твердый раствор углерода в железе), а роль катода – структурные составляющие или примеси, потенциал которых наиболее положителен (например, Fe3C – карбид железа). На анодных участках поверхности происходит процесс окисления металла: (−) А (Fe): Fe На катодных участках (Fe3C) протекают процессы восстановления. В зависимости от условий и состава окружающей среды эти процессы могут быть различны. На поверхности металлов и сплавов в атмосферных условиях всегда имеется тонкая адсорбционная пленка влаги, растворяющая О2, СО2, SO2, HCl и другие вещества, содержащиеся в окружающей среде. Растворенные вещества могут принимать участие в катодном процессе в качестве окислителя. Наиболее распространенными являются следующие катодные процессы: Восстановление кислорода, растворенного в воде (+) K (Fe3C): 4OH- + 4 Восстановление ионов водорода (+) K (Fe3C): 2Н++ 2 При атмосферной коррозии железа и его сплавов конечным продуктом коррозии является ржавчина, которая образуется в результате взаимодействия продуктов анодного и катодного процессов на поверхности металла: Fe2++ 2OH-® Fe(OH)2; 4Fe(OH)2 + O2 + 2H2O ® 4Fe(OH)3 Последнее уравнение представляет собой упрощенную схему. В действительности процесс окисления и гидратации идет более сложно и наряду с Fe(OH)3 образуются такие вещества, как FeOOH, Fe2O3, Fe3O4 в различных соотношениях.
|

 Меn+ + n
Меn+ + n  .
. (рН
(рН  7).
7). < E
< E  .
. =1 атм, равен E
=1 атм, равен E  , E
, E  =−0,059 рН.
=−0,059 рН. =0,1 МПа представлены в табл. 10.1.
=0,1 МПа представлены в табл. 10.1. = −0,059 рН, В
= −0,059 рН, В
 7).
7). =1атм, равен Е
=1атм, равен Е 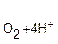 /
/  , Е
, Е  /
/  =1,229–0,059рН.
=1,229–0,059рН. , МПа
, МПа
 .
.


