
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
For Whom The Bell Tolls 27 страница
Дата добавления: 2015-08-29; просмотров: 480
|
|
В анионной полимеризации, так же как и в катионной, активные центры на концах растущих цепей могут находиться в виде ионных пар с различной степенью разделенности зарядов и свободных ионов. Влияние растворителя и противоиона на скорость анионной полимеризации больше по сравнению с катионной и обусловлено, в первую очередь, изменением степени диссоциации ионной пары. О влиянии растворителя можно судить, исходя из значений эффективных констант скорости роста. Для живой анионной полимеризации скорость роста описывается выражением (5.83). Типичный пример приведен в табл. 5.10, из которой следует, что с увеличением полярности растворителя эффективная константа скорости роста макроаниона полистирола возрастает на три порядка.
Влияние противоиона иллюстрируется данными анионной полимеризации стирола. Изменение природы противоиона в порядке Li+Na+K+Rb+Cs+ приводит к закономерному изменению константы диссоциации ионной пары (2,2; 1,5; 0,8; 0,1; 0,02)·10-7 моль/л, что, в свою очередь, вызывает уменьшение константы скорости роста 160, 80, 70, 65, 22 л/(моль·с). Эффект связан с уменьшением плотности заряда противоиона и степени его сольватации растворителем в приведенном ряду. Естественно, что реакционная способность свободных ионов роста не зависит от природы противоиона - во всех случаях 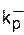 = 6,5·104 л/(моль·с).
= 6,5·104 л/(моль·с).
Влияние температуры на скорость анионной полимеризации связано сдвумя эффектами - изменением степени диссоциации ионной пары и аррениусовской зависимостью констант скоростей роста с участием различных типов активных центров от температуры. Энергия активации диссоциации
Таблица 5.10 Влияние растворителя на анионную «живую» полимеризацию стирола, 25°С, натрий-нафталиновый комплекс 3·10-3 моль/л
| Растворитель | Диэлектрическая постоянная ε | 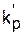 *, л/(моль·с) *, л/(моль·с)
|
| Бензол 1,4-Диоксан Тетрагидрофуран 1,2-Диметоксиэтан | 2,2 2,2 7,6 5,5 |
* Эффективная константа скорости роста.
Таблица 5.11 Кинетические и термодинамические характеристики реакции роста цепи при живой полимеризации стирола, инициируемой натрий-нафталином, 20°С, тетрагидрофуран
| Тип ионной пары | Характеристика* | Значение |
| Контактная | kc Ec Ac | 24 л/(моль·с) 36,0 кДж/моль 6,3·107 л/(моль·с) |
| Сольватно-разделенная | ks Es As | 5,5·104 л/(моль·с) 19,7 кДж/моль 2,08·108 л/(моль·с) |
| Свободный ион | 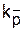
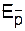
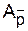 K
K
| 1,З·105 л/(моль·с) 16,6 кДж/моль 1,0·108 л/(моль·с) 4,0·10-8 моль/л, 20°С 79,1·10-8 моль/л,-48°С |
* kc, ks, 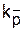 , Ec, Es,
, Ec, Es, 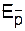 , Ac, As,
, Ac, As, 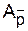 - константы скорости, энергии активации, частотныефакторы (предэкспоненциальные множители) реакции роста цепи с участием контактных пар, сольватированных (разделенных) и свободных ионов, К - константа диссоциации.
- константы скорости, энергии активации, частотныефакторы (предэкспоненциальные множители) реакции роста цепи с участием контактных пар, сольватированных (разделенных) и свободных ионов, К - константа диссоциации.
ионной пары отрицательна, поэтому при уменьшении температуры константа ее диссоциации возрастает, что можно видеть из данных нижней части табл. 5.11.
Из табл. 5.11 следует, что энергии активации реакции роста с участием всех типов активных центров положительны, следовательно, соответствующие константы скоростей роста цепи с уменьшением температуры уменьшаются. Противоположное влияние температуры на константы диссоциации ионной пары и константы скорости реакции роста приводит к низким значениям эффективной энергии активации живой анионной полимеризации в хороших, т.е. сольватирующих растворителях. Так, при полимеризации стирола, инициируемой натрий-нафталином в сольватирующем растворителе тетрагидрофуране, Е = 4,2 кДж/моль. Однако при той же полимеризации в плохом, слабо сольватирующем растворителе диоксане Е = = 37,6 кДж/моль. Это объясняется тем, что в слабо сольватирующих растворителях, подобных диоксану, константа диссоциации слабо зависит от температуры. Поэтому значение эффективной суммарной энергии активации определяется в основном энергией активации реакции роста, которая достаточно велика для реакции с участием контактных пар, преобладающих в несольватирующих растворителях.
В табл. 5.11 приведены также значения констант скоростей реакции роста анионной полимеризации стирола с участием различных типов активных центров. Видно, что наиболее значительно - на три порядка - отличаются константы скорости роста на контактных и сольватно-разделенных ионных парах, что связано с наибольшей разницей в энергиях активации соответствующих элементарных актов.
| <== предыдущая лекция | | | следующая лекция ==> |
| For Whom The Bell Tolls 26 страница | | | For Whom The Bell Tolls 28 страница |