Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
ГЛАВА 1
Дата добавления: 2015-09-18; просмотров: 697
|
|
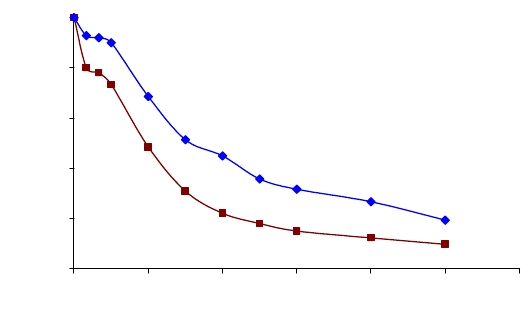
Рисунок 18 - Зависимость разложения пустых (1) и иммобилизованных
капреомицина сульфатом (2) наночастиц во времени
Из кривой зависимости видно, что около 50 % пустых наночастиц
73
|

подверглось разложению за 3 часа, а остаток через 10 часов составил 19,4 %
полимера. Далее исследовали разложение наночастиц с биологически активным
веществом во времени (рисунок 18). Из рисунка видно, что разложение
наночастиц полэтилцианоакрилата, иммобилизованного капреомицина
сульфата происходит несколько быстрее. На первом этапе около 70 %
полэтилцианоакрилат разлагается в течение 3-х часов, связанное, по всей
видимости, с более высокой эрозией поверхности полимера и деградацией
полэтилцианоакрилата блоками.
Экспериментальные данные показывают, что полимер, иммобилизованный
капреомицина сульфат, деградирует быстрее, чем пустые
полиэтилцианоакрилатные наночастицы. Таким образом, полученные
результаты дают основания утверждать, что присутствие лекарства в
полимерной матрице нескльно ускоряет процесс разложения наночастиц.
В биологических условиях полимеры подвергаются деструкции с
изменением или без изменения в их химической структуре или они могут
деградировать химически, также могут иметь место оба процесса. Существуют
2 общепринятых механизма деградации полиалкилцианоакрилатов [15, c.29; 68,
c.650; 70, c.535]:
1) Деградация основной цепи полимера с образованием формальдегида.
2) Отщепление эфирной группы, приводящее к образованию растворимой
полиалкилцианоакриловой кислоты.
Первый способ деградации является обратным реакции конденсации
Кневенагеля, и полагают, что деструкция полиалкилцианоакрилатов этим
путем протекает гораздо медленнее. При деградации вторым способом,
основная цепь полимера остается незатронутой, но гидрофобная цепь
становится все более и более гидрофильной, пока не станет полностью
водорастворимой, а образующиеся в результате деградации
низкомолекулярные продукты выводятся из организма за короткий срок. На
сегодняшний день увеличивается количество работ, указывающих на
преобладание деградации полиалкилцианоакрилатов вторым путем над первым
[15, c.29; 68, c.650; 70, c.536].
Схема химической деградации полиалкилцианоакрилатов гидролизом
эфирной группы, приводящая к образованию спирта и
полиалкилцианоакриловой кислоты, показана ниже (рисунок 19).
CN
CN
CN
CN
CN
CN
OH-
- CH2 - C - CH2 - C - CH2 - C -
- nROH
- CH2 - C - CH2 - C - CH2 - C -
COOR
COOR
COOR
COO-
COO-
COO-
Рисунок 19 - Деградация полиалкилцианоакрилатов
74 













Полиалкилцианоакрилаты относятся к быстро деградируемым полимерам,
таким образом, они могут покидать организм в течение нескольких дней [15,
c.30]. Скорость деградации полиалкилцианоакрилатов зависит от длины
боковой цепи: чем длиннее цепь, тем медленнее процесс деградации (т.е.
полиметил-
и полиэтилцианоакрилаты подвергаются очень быстрой
деградации) [15, c.29; 68, c.651. Возможно этим и объясняется относительно
быстрая биодеградация полиэтилцианоакрилата. Кроме того, низкая
молекулярная масса полимера (около 2000) также может быть причиной его
быстрой деградации. Выделение этанола в среду в результате деструкции, как
показано в схеме, свидетельствует о деградации полиэтилцианоакрилата
вторым путем. Так, методом газовой хроматографии обнаружено, что
содержание этанола в среде составило 6,8 %. На основании вышеизложенного
можно заключить, что только небольшая часть (около 7 %)
полиэтилцианоакрилата, иммобилизованного лекарством, деградировало
посредством гидролиза эфирной группы. Далее не удалось УФ-
спектрофотометрически определить количество высвободившегося лекарства
из-за образования этанола в среде, пик которого покрывал область поглощения
лекарства.
Таким образом в результате проведенных исследований показано, что
высвобождение эрозией поверхности наночастиц превалирует над процессами
деградации макромолекул полимерных матриц. Из вышесказанного можно
заключить, что полимеры на основе этилцианоакрилата могут быть
использованы в качестве носителей для транспорта противотуберкулезного
препарата капреомицина сульфата. Высвобождение лекарства из
полиэтилцианоакрилатных наночастиц происходит вследствие деградации
полимера. Установлено, что включение капреомицина сульфата в матрицу
полиэтилцианоакрилата позволяет увеличить время полувыведения лекарства в
3 раза, таким образом пролонгируя действие лекарственного препарата.
3.1.2 Синтез и характеристика полиэтилцианоакрилатных нанокапсул,
иммобилизованных противотуберкулезным препаратом капреомицина
сульфатом
Наиболее оптимальным путем при разработке наносомальных форм
лекарственных препаратов является создание нанокапсул
на основе
биосовместимых полимеров, так как будучи полой, капсулы имеют большую
емкость, что позволяет надеяться на максимальное наполнение их лекарством.
В настоящее время существуют различные методы приготовления пустых
структур для различных целей. Пустые микро- и нанокапсулы играют
немаловажную роль и в фармацевтическом производстве. Капсулирование
лекарств в пустые полимерные наноструктуры дает специальные возможности,
такие как защита лекарства от разложения в биологической среде, скрытие
неприятного
вкуса лекарства, более того, возможно осуществление
контролируемого высвобождения лекарственного вещества через
полупроницаемую и/или стимул-чувствительную (термо-
и/или рН-
чувствительную) мембрану или обеспечение высвобождения биологически
активного вещества созданием биодеградируемой оболочки. Для получения
нанокапсул используются различные методы, например, нанесение одного слоя
на другой в случае липосом и везикул [26, c.413; 27, c.5122; 28, c.7315; 29,
c.1861], метод «жертвенного» ядра, при котором ядро капсулы удаляют после
образования плотной, стабильной оболочки [26,
c.414],
межфазная
полимеризация или поликонденсация в миниэмульсиях [26, c.413; 27, c.5122;
28, c.7315; 29, c.1861] и другие [26, c.416]. Один из наиболее эффективных
способов синтеза пустых или наполненных полимерных капсул – проведение
полимеризации на поверхности соприкосновения фаз вода в масле (в/м) или
масло в воде (м/в). Этот метод позволяет получить нанокапсулы, содержащие
жидкое ядро, в одну стадию с удовлетворительными характеристиками.
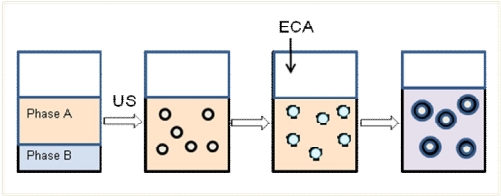
Схема получения нанокапсул методом межфазной полимеризации в
инверсионных миниэмульсиях показана на рисунке 20.
фаза А – органическая фаза, фаза B – водная фаза
Рисунок 20 - Упрощенная схема принципа полимеризации в инверсионных
миниэмульсиях
В настоящей работе исследована возможность нанокапсулирования
капреомицина сульфата полиэтилцианоакрилатом.
Полиэтилцианоакрилатные нанокапсулы получали инверсионной
полимеризацией этилцианоакрилата в миниэмульсии по модифицированной
методике, приведенной в работе [32, c.122]. Органическую фазу, состоящую из
циклогексана и смеси ПАВ (Твин 80 : Спен 80 = 1:1, в целом 10 % от массы
органической фазы) добавляли воду, эту смесь интенсивно перемешивали в
течение 30 минут при комнатной температуре (298 К). Затем макроэмульсию
молочного цвета подвергали ультразвуковой обработке в течение 20 минут (по
2 минуты с перерывами и 10 мин без перерыва) при 50 % амплитуде (в режиме
5 сек. - УЗ, 10 сек. – пауза). В течение этого процесса систему охлаждали
льдом. рН водной среды поддерживали 2,0-2,5 буферным раствором. Затем,
отобрав из образовавшейся миниэмульсии 10 мл, по каплям добавляли
рассчитанное количество этилцианоакрилата (ЭЦА) и катализатора при
постоянном перемешивании (600 об/мин). После 4-х часов полимеризации
76
|
полиэтилцианоакрилатные нанокапсулы отделяли от органической фазы
центрифугированием при 14000 об/мин в течение 1ч., промывали и
диспергировали в воду.
На первоначальном этапе изучена возможность получения пустых
нанокапсул полиэтилцианоакрилата при варьировании концентрации мономера
(таблица 8).
Таблица 8 - Инверсионная полимеризация этилцианоакрилата: Т = 250С, [kat] =
0,01 %, [Твин 80] = [Спен 80] = 10 %
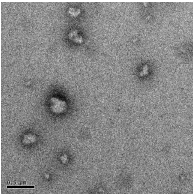
На электронно-микроскопических снимках (рисунок 21) показаны
наноструктуры, синтезированные в результате полимеризации в инверсионной
миниэмульсии и после обработки образцов ультразвуком (УЗ).
[ЭЦА] = 0,89 моль/л от водной фазы (
200 нм)
Рисунок 21 – Электронно микроскопические снимки наноструктур
полиэтилцианоакрилата
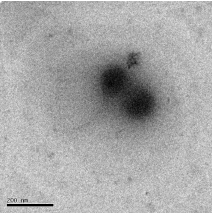
Из рисунков видно, что синтезированы твердые частицы
полиэтилцианоакрилата размерами 80-100 нм, но образование нанокапсул не
наблюдается, а также заметно формирование ассоциациатов частиц очень
малого размера, что, по всей видимости, связано с тем, что полученные в
процессе реакции пустые капсулы из-за рыхлости оболочек, коллапсировали
под воздействием УЗ на стадии их диспергирования в воду, что привело к
77 
|
|
|
образованию твердых полиэтилцианоакрилатных наночастиц. При получении
нанокапсул, предпочтительнее формирование капсул с достаточно плотной
оболочкой, так как в противном случае могут образоваться твердые частицы в
результате коллапса капсул при обработке их ультразвуком. С целью синтеза
полимера с более высокой молекулярной массой и капсул с плотной оболочкой
в последующих экспериментах содержание этилцианоакрилата уменьшили до
0,67 моль/л (7,5 % от массы водной фазы). Результаты приведены на рисунке
22.
[ЭЦА] = 0,67 моль/л от водной фазы (
200 нм)
Рисунок 22 - Электронно-микроскопические снимки наноструктур
полиэтилцианоакрилата
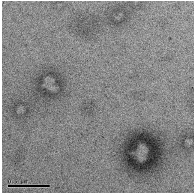
Из трансмиссионно-электронно микроскопических снимков
полиэтилцианоакрилата можно заключить, что помимо образования пустых
наноструктур искаженной формы, в системе также имеются твердые частицы
полимера. Образовавшиеся структуры «ядро-оболочка» имеют размеры 50-100
нм (рисунок 22). Из рисунков также видно, что оболочки капсул недостаточно
плотны, и поэтому стены некоторых капсул частично разрушены, а результате
чего на снимках видны бесформенные структуры. Мягкие и тонкие стены
нанокапсул могут вызвать утечку вещества изнутри капсул, так как ядро капсул
является жидкостью (например, раствором лекарства).
С целью получения стабильных нанокапсул полиэтилцианоакрилата
78 
|
|
|
|
концентрацию мономера уменьшили до 0,53 моль/л (6 % от массы водной
фазы), однако это не дало желаемых результатов, - получены твердые частицы
нанометрического размера (рисунок 23).
[ЭЦА] = 0,53 моль/л от водной фазы (
200 нм)
Рисунок 23 - Электронно-микроскопические снимки наноструктур
полиэтилцианоакрилата
В последующих экспериментах, варьируя соотношения компонентов
системы (Твина 80 и Спена 80, водной и органической фаз, концентрацию
мономера) найдены оптимальные условия синтеза пустых нанокапсул
полиэтилцианоакрилата. Так, для получения полиэтилцианоакрилатных
нанокапсул наиболее оптимальным соотношением ПАВ можно считать: Твин
80 : Спен 80 = 1:1 (10 % от массы органической фазы), концентрацию мономера
- СЭЦA = 0,42 моль/л от массы водной фазы, соотношение органической и
водной фаз 3,8 : 1 соответственно. В результате использования таких
соотношений компонентов инверсионной полимеризацией в миниэмульсии
синтезированы пустые нанокапсулы полиэтилцианоакрилата с
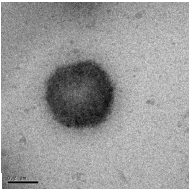
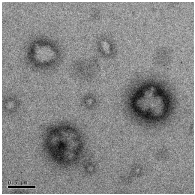
удовлетворительными характеристиками [148]. На рисунке 24 приведены
электронно-микроскопические снимки полученных полиэтилцианоакрилатных
нанокапсул после диспергирования их в воду.
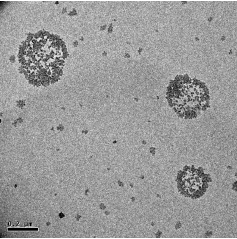
Из приведенных снимков видно, что полученные нанокапсулы имеют
правильную сферическую форму и оболочку средней толщины, что важно при
синтезе нанокапсул, так как толщина стенки нанокапсул и деградирующая
способность полимера определяют характер и скорость высвобождения
капсулированного соединения.
Молекулярная масса полученных нанокапсул полиэтилцианоакрилата,
определенная методом гель проникающей хроматографии, составила около 600
(596), что соответствует приблизительно 4 звеньям мономера. Образование
полимера низкой молекулярной массы может быть связано с достаточно
высокой скоростью процесса полимеризации, что, по всей видимости, привело
79 
|
|
к образованию коротких олигомерных цепей. Выход нанокапсул, определенный
методом гравиметрии, составил 80 %.
[ЭЦА] = 0,42 моль/л от водной фазы (
200 нм)
Рисунок 24 - Электронно-микроскопические снимки пустых нанокапсул
полиэтилцианоакрилата
Полученные нанокапсулы, ядром которых является вода, дают
возможность в дальнейшем осуществить капсулирование водорастворимых
соединений, в том числе, гидрофильных лекарственных препаратов. Средний
размер нанокапсул составляет 300-400 нм, что отвечает требованиям
полимерных носителей лекарственных препаратов.
В продолжение исследований нами осуществлена попытка
нанокапсулирования противотуберкулезного препарата капреомицина
сульфата. Синтез полиэтилцианоакрилатных нанокапсул, иммобилизованных
лекарством, проводили растворением капреомицина сульфата в водной фазе,
используя соотношение [ЭЦА] : [КС] = 1:1. Полученные нанокапсулы,
содержащие капреомицина сульфат, промывали водой, затем этанолом и
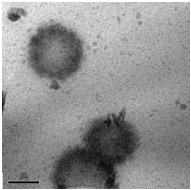
сушили на воздухе. Снимки полученных нанокапсул, иммобилизованных
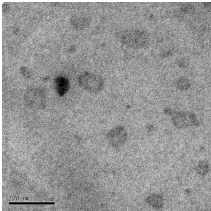
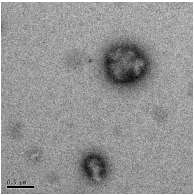
лекарством, приведены на рисунке 25.
[ЭЦА] : [КС] = 1 : 1, (
500 нм)
Рисунок 25 - Электронно-микроскопические снимки полиэтилцианоакрилатных
нанокапсул, иммобилизованных капреомицина сульфатом
80 

|
|
|
|
|
|
Данные, полученные фотонной корреляционной спектроскопией, показали,
что средний диаметр иммобилизованных лекарством нанокапсул составил 512
нм, что
коррелирует с результатами трансмиссионной электронной
микроскопии.
Эффективность включения капреомицина сульфата в
полиэтилцианоакрилатные нанокапсулы определяли по методике, приведенной
в работе [32, c.125]: высушенные до постоянной массы капсулы, содержащие
лекарство растворяли в хлороформе (1 мг/мл), затем лекарство экстрагировали
из органической фазы фосфатным буферным раствором (рН 7,4) в течение 5
часов. Содержание лекарства в водном растворе определяли методом УФ-
спектроскопии (λmax = 268 нм). Эффективность включения капреомицина
сульфата в полиэтилцианоакрилатные нанокапсулы в этом случае составила
22,1 %. Довольно низкое содержание лекарственного вещества в нанокапсулах,
возможно, объясняется утечкой значительного количества лекарства из
нанокапсул, тонкие стенки которых, по всей видимости, были частично
разрушены во время их промывания и сушки.
В связи с этим, для получения капсул с оболочками достаточной толщины
и повышения эффективности включения лекарства в последующих
экспериментах концентрацию мономера варьировали в пределах 0,42-0,89
моль/л. Полученные результаты приведены в таблице 9.
Таблица 9 - Полиэтилцианоакрилатные нанокапсулы, иммобилизованные
капреомицина сульфатом: Т = 250С, [kat] = 0,01 %, [Твин 80] = [Спен 80] = 10 %
Из таблицы видно, что наиболее эффективным оказалась концентрация
мономера 0,89 моль/л, при которой удалось добиться увеличения
эффективности включения почти в 2 раза (таблица 9). Диаметр полученных
капсул уменьшается с увеличением концентрации этилцианоакрилата в
системе, что, по всей видимости, вызвано компактизацией структур полимера.
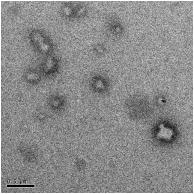
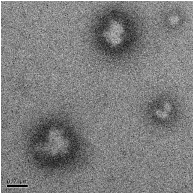
Электронно-микроскопические снимки полиэтилцианоакрилатных
нанокапсул, полученных при использовании концентрации мономера 0,89
моль/л, показаны на рисунке 26.
81
|
[ЭЦА] : [КС] = 2:1, (
500 нм)
Рисунок 26 - Полиэтилцианоакрилатные нанокапсулы, иммобилизованные
капреомицина сульфатом
В этом случае эффективность включения, рассчитанная с использованием
вышеназванной методики, составила 41,3 %, что является достаточно высоким
показателем.
Трансмиссионные электронно-микроскопические снимки указывают на
образование полиэтилцианоакрилатных нанокапсул со средним размером около
250-500 нм (рисунок 26), что согласуется с данными, полученными методом
фотонной корреляционной спектроскопии: средний диаметр капсул после
промывания и диспергирования их в воду с использованием УЗ, составил 260
нм (полидисперсность 0,438).
Молекулярная масса полученного продукта, определенная гель
проникающей хроматографией, составила Mn = 1252 (Mw = 2070, PDI = 1,65),
что приблизительно соответствует 10 мономерным звеньям (1250).
Таким образом, методом инверсионной эмульсионной полимеризации
получены полиэтилцианоакрилатные нанокапсулы, иммобилизованные
противотуберкулезным препаратом капреомицина сульфатом, с
удовлетворительными физико-химическими характеристиками и хорошей
морфологией, которые перспективны в качестве полимерных носителей.
82 
|
|
|
|
|
|
3.1.3 Синтез полимерных наночастиц на основе полибутилцианоакрилата
для транспорта противоопухолевого препарата «Арглабин»
В настоящее время одной из важных задач современной медицины
является проблема лечения раковых заболеваний. По данным Международного
агентства по исследованию рака за 2000 г. злокачественная опухоль поразила
10 млн. человек в мире и привело к гибели 4/5 из них. Интенсивная терапия
раковых заболеваний с применением высоких доз сильнодействующих
препаратов приводит к выраженным побочным эффектам, в связи с этим,
разработка новых противоопухолевых препаратов и методов лечения
злокачественных опухолей до сих пор остается актуальной и не до конца
решенной проблемой.
На фармацевтическом рынке нашей страны в настоящее время существуют
различные препараты, обладающие высокой противоопухолевой активностью.
Одним из таких лекарственных препаратов является отечественный
противоопухолевый препарат «Арглабин», полученный АО МНПХ
«Фитохимия» из растения Центрального Казахстана полыни гладкой –
Artemisia glabella [149]. Исследование Арглабина и ряда его производных
показало, что наиболее выраженной противоопухолевой активностью обладают
эпоксиарглабин и гидрохлорид диметиламиноарглабина (рисунок 27).
Эпоксиарглабин (далее нативный арглабин или субстанция) не нашел
применения в виду не растворимости в воде. В дальнейшем на основе
гидрохлорида диметиламиноарглабина, который обладает высокой
противоопухолевой активностью и является водорастворимым веществом, была
разработана лиофилизированная лекарственная форма для парентерального
введения – препарат «Арглабин».
| <== предыдущая лекция | | | следующая лекция ==> |
| ПЕРЕДМОВА | | | Інститут виключного права |