Моль. Молярна маса. Закон АвогадроМОЛЬ – це одиниця кількості речовини, що містить стільки структурних одиниць (молекул, атомів, йонів, електронів тощо), скільки атомів міститься у 0, 012 кг ізотопу Карбону С12. МОЛЬ - це стандарт кількості речовини в хімії.
МОЛЯРНА МАСА (М) - це маса одного моль речовини (маса моль атомів, моль молекул або інших частинок). Молярна маса дорівнює відносній атомній або молекулярній масі, а виражається в г/моль. Для молярної маси існує співвідношення: m = ν • M; де: m – маса речовини, г; ν – кількість речовини, моль; M – молярна маса речовини, г/моль. Наприклад: 1)Відносна атомна маса Аr(Са) = 40, молярна маса М(Са) = 40 г/моль значить маса 1 моль атомів (6, 02•1023 атомів) кальцію = 40 грам. 2) Відносна молекулярна маса Мr(HNO3) = 63, молярна маса М(HNO3) = 63 г/мользначить маса 1 моль молекул (6, 02•1023 молекул) HNO3 = 63 грами. КІЛЬКІСТЬ РЕЧОВИНИ (ν) (нью) – це фізична величина, яка визначається числом структурних частинок (молекул, атомів і ін.), що містяться в даній порції речовини.
Знаючи масу одного атома карбону (1, 993•10-26 кг), можна визначити число атомів (NA) у 0, 012 кг Карбону:
Це число називають сталою Авогадро (позначають NA, моль-1). Стала Авогадро показує число структурних одиниць у молі будь-якої речовини. Наприклад: 1 мольмолекулН2О – це 6, 02 • 10 23 молекул Н2О; або 12, 04•1023 атомів Н і 6, 02•1023 атомів О. 2 моль молекул О2 – це 12, 04 • 1023 молекул О2 і 24, 08•1023 атомів О. Закон Авогадро – в рівних об′ ємах різних газів при однаковій температурі міститься однакова кількість молекул.
МОЛЯРНИЙ ОБ'ЄМ ГАЗУ (Vm) – це об'єм 1 моль газу. За нормальних умов (н.у. - 0°С або 273К, 101, 3 кПа) молярний об'єм газів Vm = 22, 4 моль/л. Знаючи об′ єм газу можна розрахувати кількість речовини (моль), яка в ньому знаходяться:
§1.6. Основні закони хімії 1. Закон збереження маси: маса речовин, які вступили в реакцію, дорівнює масі продуктів реакції. Тобто, атоми не змінюються в хімічних реакціях, а тільки переходять з одних молекул в інші. Маса (реагентів) = Маса (продуктівреакції) 3NаОН + Н3РО4 = Na3PO4 + 3Н2О 3 • 40 г/моль + 98 г/моль = 164 г/моль + 3 • 18г/моль
2. Закон СТАЛОСТІ складу: кожна чиста речовина молекулярної будови має постійний склад, який не залежить від місця і способу одержання речовини.
ВІДНОСНА ГУСТИНА ГАЗІВ (D) – дорівнює відношенню молярних мас газів.
Як правило густину газів обчислюють відносно:
МАСОВА ЧАСТКА ЕЛЕМЕНТУ У СПОЛУЦІ – це відношення мас всіх атомів елементу до відносної молекулярної маси сполуки.
§1.7. Приклади розв’язування задач Задача 1. Скільки моль і скільки молекул містить 1 кг крейди (СаСО3)?
Відповідь: 1 кг крейди містить 10 моль молекул та 6, 02•1024 молекул СаСО3. Задача 2. Знайти відносну густину аміаку (NH3) за киснем (О2).
Відповідь: Відносна густина аміаку за киснем дорівнює 0, 531.
Задача 3. Обчислити масові частки елементів Нітрогену (N) і Оксигену (О) в нітратній кислоті НNO3.
Відповідь: Масова частка Оксигену дорівнює 76%, а Нітрогену 22%.
|



 1 моль Fe
1 моль S
1 моль Fe
1 моль S
 звідки:
звідки: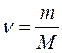





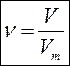
 - при н.у.
- при н.у.

 218 г/моль = 218 г/моль
218 г/моль = 218 г/моль


 = 10 моль (СаСО3)
2. Знайдемо кількість молекул СаСО3 в 1 кг крейди.
N = v • NA
N молекул = 10 моль•6, 02•1023 моль-1 =
6, 02 • 10 24 молекул СаСО3
= 10 моль (СаСО3)
2. Знайдемо кількість молекул СаСО3 в 1 кг крейди.
N = v • NA
N молекул = 10 моль•6, 02•1023 моль-1 =
6, 02 • 10 24 молекул СаСО3
 М(NH3) = 14 + 3•1 = 17 г/моль
М(O2) = 2•16 = 32 г/моль
М(NH3) = 14 + 3•1 = 17 г/моль
М(O2) = 2•16 = 32 г/моль
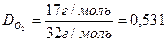
 Mr(HNO3)= Ar(H)+ Ar(N)+ 3•Ar(O)= 1 + 14 + 3•16 = 63.
Mr(HNO3)= Ar(H)+ Ar(N)+ 3•Ar(O)= 1 + 14 + 3•16 = 63.
 або 0, 22 • 100% = 22%
або 0, 22 • 100% = 22%
 або 0, 76 • 100% = 76%
або 0, 76 • 100% = 76%



