Спектрометрический метод определения константы диссоциации индикатора фенолфталеина
Некоторые вещества приобретают в диссоциированном и недиссоциированном состоянии различную окраску, что позволяет их использовать в качестве индикаторов. Перемена окраски связана с отрывом иона водорода или гидроксила от молекулы, остаток которой испытывает деформацию электронной структуры. Это вызывает изменение спектра поглощения и, соответственно, окраски образовавшегося иона. Если индикатор является слабой кислотой, то диссоциация выражается уравнением:
В кислой среде равновесие сдвинуто влево, и окраска раствора определяется цветом исходной молекулы. В щелочной среде равновесие сдвинуто вправо, и окраску раствора определяет цвет аниона (индикатора). Окраска раствора индикатора зависит от величины рН раствора и выражается уравнением:
где: К – константа диссоциации индикатора;
Когда индикатор диссоциирован наполовину (α = 0,5), то второй член уравнения (7) равен нулю и рН = рК. Это значение рН называется точкой перехода индикатора. Изменение окраски происходит в определенном интервале рН, причем визуально это можно заметить, когда отношение окрашенных форм лежит в пределах двух единиц рН. Индикаторы бывают одноцветные (например, фенолфталеин), и двухцветные, окрашенные в различные цвета в каждой из форм (например, метилоранж, лакмус и др.). Определение константы диссоциации индикатора основано на уравнении (7). В соответствии с табл. 1 приготовить 4 состава буферных растворов в объеме по 25 мл из стандартных растворов по ГОСТ 4919.2-77. Проверить растворы на рН-метре. Таблица 1
К каждому буферному раствору приливают 0,05 мл фенолфталеина, перемешивают и выдерживают для установления равновесия. На спектрофотометре на длине волны 540 нм определяют оптическую плотность каждого буферного раствора, начиная с наименее окрашенного. Каждое определение повторяют не менее трех раз. Максимальная оптическая плотность (Dmах) в ряду буферных смесей с возрастающим значением рН отвечает полной диссоциации индикатора (α = 1), для других значений рН, α находится по соотношению α = D/Dmах. Все экспериментальные значения и расчетные величины заносят в табл.2. Таблица 2
Строят график зависимости α = ƒ (рН), по графику находят точку перехода индикатора pH=pK, соответствующую значению α = 0,5. Определить видимую зону перехода индикатора по формуле
5. Определение содержания ионов меди в растворе по градуировочному графику Определение ионов меди (II) основано на образовании ими комплексного соединения с аммиаком - тетрааммиаката меди с интенсивной голубой окраской по реакции: Cu+2 + 4 NH3+ Такой способ используется для определения содержания меди в сплавах, лаках, электролитах и объектах окружающей среды. 5.1. Приготовление стандартных образцов Приготовить серию стандартных растворов, для чего в пять мерных колб на 25 млотмерить по 5 мл дистиллированнойводы и последовательно в каждую внести 4; 5; 6; 8 и 10 млстандартного раствора CuSO4 (с концентрацией 6,5 мг Cu+2/мл). В каждую мерную колбу добавить по 5 мл раствора аммиака ( 5.2. Построение градуировочного графика Измерить оптическую плотность при установленной длине волны 615 нм всех стандартных растворов, используя в качестве раствора сравнения дистиллированную воду. Измерения начать с раствора наименьшей концентрацией, а затем последовательно остальные. Кюветы необходимо тщательно промыть дистиллированной водой и при замене пробы кювету следует ополоснуть 2 - 3 раза новым раствором. Все результаты измерений и расчеты занести в таблицу 3. Таблица 3
Построить график зависимости оптической плотности D в зависимости от массы ионов Cu+2 в растворе (С). При необходимости применить методы статической обработки эксперимента. 5.3. Определение содержания ионов мели в контрольном образце Получить у преподавателя в мерную колбу на 25 мл (№6), аликвоту контрольного раствора меди объемом 10 мл и подготовить ее к спектрофотометрированию, как описано в пункте 5.1. По градуировочному графику определить массу ионов меди в контрольном растворе. В соответствии с разделом 3.2.4 ввести коэффициент градуировочного уравнения С (линейное уравнение вида
|

 (6)
(6)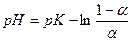 (7)
(7) - степень диссоциации индикатора.
- степень диссоциации индикатора. (8)
(8) [Cu(NH)3]+2
[Cu(NH)3]+2 ) и довести объем раствора дистиллированной водой до метки Раствор тщательно перемешать.
) и довести объем раствора дистиллированной водой до метки Раствор тщательно перемешать. ) в память прибора и определить концентрацию ионов меди в контрольном образце.
) в память прибора и определить концентрацию ионов меди в контрольном образце.


