Материальный баланс
§Ґ§Э§с §д§а§Ф§а §й§д§а§Т§н §б§а§Э§е§й§С§д§о §Т§а§Э§о§к§Ъ§Ц §Ь§а§Э§Ъ§й§Ц§г§д§У§С §С§Щ§а§д§Я§а§Ы §Ь§Ъ§г§Э§а§д§н, §Ъ§г§б§а§Э§о§Щ§е§Ы§д§Ц §г§Э§Ц§Х§е§р§л§Ъ§Ы §С§б§б§С§в§С§д. Ўм §§а§в§б§е§г. §±§а§Э-§Э§Ъ§д§в§а§У§С§с §Ъ§Э§Ъ §Э§Ъ§д§в§а§У§С§с §Т§С§Я§Ь§С. §®§а§Ш§Я§а §б§а§Х§а§Т§в§С§д§о §г§д§Ц§Ь§Э§с§Я§Я§е§р §Т§С§Я§Ь§е §г §Щ§С§У§Ъ§Я§й§Ъ§У§С§р§л§Ц§Ы§г§с §Ь§в§н§к§Ь§а§Ы §а§д §Ю§С§Ф§С§Щ§Ъ§Я§Я§н§з §Ь§а§Я§г§Ц§в§У§а§У (§Ь§в§н§к§Ь§е §У§н§Ь§Ъ§Я§е§д§о) – §Ф§а§в§Э§н§к§Ь§а §е §Я§Ъ§з §Ъ§Ю§Ц§Ц§д §Я§Ц§г§Ь§а§Э§о§Ь§а §Ю§Ц§Я§о§к§Ъ§Ы §Х§Ъ§С§Ю§Ц§д§в, §й§Ц§Ю §е §г§д§С§Я§Х§С§в§д§Я§н§з §Т§С§Я§а§Ь §Ъ §Ъ§Х§Ц§С§Э§о§Я§а §б§а§Х§з§а§Х§с§д §б§а§Х §Ь§в§н§к§Ь§е (§г§Ю. §Я§Ъ§Ш§Ц). Ўм §§в§н§к§Ь§С ª. §Б §Я§Ц §Я§С§к§Ц§Э §е §г§Ц§Т§с §г§д§Ц§Ь§Э§с§Я§Я§а§Ы §Ь§в§н§к§Ь§Ъ §а§д §Ь§а§ж§Ц, §Щ§С§д§а §Я§С§к§Ц§Э §г§д§Ц§Ь§Э§с§Я§Я§е§р §Ь§в§н§к§Ь§е §Х§Э§с §Х§а§Ю§С§к§Я§Ц§Ф§а §Ь§а§Я§г§Ц§в§У§Ъ§в§а§У§С§Я§Ъ§с. §і§Ц§Ы§й§С§г §с §Ъ§з §У §б§в§а§Х§С§Ш§Ц §Я§Ц §У§Ъ§Ш§е, §Я§а §е §Ь§С§Ш§Х§а§Ы §Х§а§Ю§а§з§а§Щ§с§Ы§Ь§Ъ §а§г§д§С§Э§Ъ§г§о §Щ§С§б§С§г§н §г§а §г§д§С§в§н§з §Х§а§Т§в§н§з §У§в§Ц§Ю§Ц§Я. Ўм §і§У§Ц§в§Э§Ц§Я§Ъ§Ц. §±§а§Т§Ц§Х§Ъ§д§а§У§н§Ю §г§У§Ц§в§Э§а§Ю §г§У§Ц§в§Э§Ъ§д§о §з§в§Ц§Я§а§У§а. §§е§й§к§Ц – §С§Э§Ю§С§Щ§Я§н§Ю. §°§Т§с§Щ§С§д§Ц§Э§о§Я§а §г§Х§Ц§Э§С§д§о §к§С§Т§Э§а§Я – §б§Э§С§г§д§Ъ§Я§Ь§е §Ъ§Щ §Ф§Ц§д§Ъ§Я§С§Ь§г§С, §Х§в. §б§Э§С§г§д§Ю§С§г§г§н, §С§Э§р§Ю§Ъ§Я§Ъ§с §Ъ §д.§б. §д§а§Э§л§Ъ§Я§а§Ы 5-7 §Ю§Ю. §Ј §Я§Ц§Ы §г§У§Ц§в§Э§Ъ§д§г§с §а§д§У§Ц§в§г§д§Ъ§Ц §д§а§й§Я§а §д§С§Ь§а§Ф§а §Ш§Ц §Х§Ъ§С§Ю§Ц§д§в§С, §Ь§С§Ь§а§Ц §Т§е§Х§Ц§д §У §г§д§Ц§Ь§Э§Ц. §©§С§д§Ц§Ю §к§С§Т§Э§а§Я §Я§С§Ь§Э§С§Х§н§У§С§Ц§Ю §Я§С §г§д§Ц§Ь§Э§а, §б§в§Ъ§Ш§Ъ§Ю§С§Ц§Ю §Ъ §Я§С§й§Ъ§Я§С§Ц§Ю §г§У§Ц§в§Э§Ъ§д§о. §і§У§Ц§в§Э§Ъ§д§о §б§в§С§Ь§д§Ъ§й§Ц§г§Ь§Ъ §Т§Ц§Щ §Я§С§Ш§Ъ§Ю§С (§п§Э§Ц§Ь§д§в§а§Х§в§Ц§Э§о§р), §б§а§й§С§л§Ц §У§н§д§С§г§Ь§Ъ§У§С§д§о §г§У§Ц§в§Э§а §Ъ §а§б§е§г§Ь§С§д§о §Ц§Ф§а §У §У§а§Х§е. §і§У§Ц§в§Э§Ъ§д§о §г §Х§У§е§з §г§д§а§в§а§Я. §§а§Ф§Х§С §а§д§У§Ц§в§г§д§Ъ§с §г§а§Ы§Х§е§д§г§с §г§Х§Ц§Э§С§д§о §в§е§Э§а§Я§й§Ъ§Ь §Ъ§Щ §Я§С§Ш§Х§С§й§Ь§Ъ. §Ґ§Э§с §п§д§а§Ф§а §Я§С§Ю§а§д§С§д§о §Я§Ц§г§Ь§а§Э§о§Ь§а §У§Ъ§д§Ь§а§У §Ь§в§е§б§Я§а§Ы §Я§С§Ш§Х§С§й§Ь§Ъ §Я§С §д§а§Я§Ь§а§Ц §г§У§Ц§в§Э§а §б§а §У§г§Ц§Ы §Ц§Ф§а §Х§Э§Ъ§Я§Ц §Ъ §Щ§С§Ш§С§д§о §У §б§С§д§в§а§Я §Х§в§Ц§Э§Ъ (§з§У§а§г§д§а§У§Ъ§Ь §У§Ю§Ц§г§д§Ц §г §Я§С§Ш§Х§С§й§Ь§а§Ы). §Ј§н§в§а§У§Я§с§д§о §а§д§У§Ц§в§г§д§Ъ§Ц. Ўм §±§в§Ъ§Ш§Ъ§Ю§Я§а§Ы §Ю§Ц§з§С§Я§Ъ§Щ§Ю. §ў§Ц§в§е§д§г§с §Х§У§Ц §Ю§Ц§д§С§Э§Э§Ъ§й§Ц§г§Ь§Ъ§Ц §б§Э§С§г§д§Ъ§Я§Ь§Ъ §Х§Э§Ъ§Я§а§Ы §г§С§Я§д§Ъ§Ю§Ц§д§в§С §Я§С 3-4 §Т§а§Э§о§к§Ц, §й§Ц§Ю §Х§Ъ§С§Ю§Ц§д§в §Т§С§Я§Ь§Ъ §Ъ §к§Ъ§в§Ъ§Я§а§Ы 2,5-3 §г§Ю. §±§а §Ь§в§С§с§Ю §г§У§Ц§в§Э§с§д§г§с §б§а §а§Х§Я§а§Ю§е §а§д§У§Ц§в§г§д§Ъ§р. §Ї§Ъ§Ш§Я§с§с §б§Э§С§г§д§Ъ§Я§Ь§С §б§а§Ю§Ц§л§С§Ц§д§г§с §б§а§Х §Х§Я§а §Т§С§Я§Ь§Ъ, §С §У§Ц§в§з§Я§с§с §Я§С §Ь§в§н§к§Ь§е (§б§а§У§Ц§в§з §в§Ц§Щ§Ъ§Я§а§У§а§Ы §б§в§а§Ь§Э§С§Х§Ь§Ъ). §Ґ§С§Э§Ц§Ц §б§Э§С§г§д§Ъ§Я§Ь§Ъ §г§д§с§Ф§Ъ§У§С§р§д§г§с §Х§Э§Ъ§Я§Я§н§Ю§Ъ §У§Ъ§Я§д§С§Ю§Ъ §г §Ф§С§Ы§Ь§С§Ю§Ъ. §Ґ§Э§с §б§а§Э-§Э§Ъ§д§в§а§У§а§Ы §Т§С§Я§Ь§Ъ §Ъ§Х§Ц§С§Э§о§Я§а §б§а§Х§з§а§Х§с§д §У§Ъ§Я§д§н §а§д §г§С§Ю§а§в§С§Щ§Х§У§Ъ§Ф§С§р§л§Ъ§з§г§с §Х§р§Т§Ц§Э§Ц§Ы. §Ґ§Э§с §Э§Ъ§д§в§а§У§а§Ы – §д§а§Э§г§д§н§Ц §г§б§Ъ§и§н §а§д §Ю§а§б§Ц§Х§С. Ўм §¤§Ц§в§Ю§Ц§д§Ъ§Щ§С§и§Ъ§с. §ґ§в§е§Т§Ь§е §д§С§Ь§Ш§Ц §Ф§Ц§в§Ю§Ц§д§Ъ§Щ§Ъ§в§а§У§С§Э §г§д§Ц§Ь§Э§а§д§Ь§С§Я§о§р, §С §У §б§в§а§Ю§Ц§Ш§е§д§а§Ь §Ю§Ц§Ш§Х§е §Ь§в§н§к§Ь§а§Ы §Ъ §Т§С§Я§Ь§а§Ы §б§а§Э§а§Ш§Ъ§Э 2-3 §У§Ъ§д§Ь§С §С§г§Т§Ц§г§д§а§У§а§Ф§а §к§Я§е§в§С §Х§Ъ§С§Ю§Ц§д§в§а§Ю 2 §Ю§Ю. §¦§Ф§а §Ъ§г§б§а§Э§о§Щ§е§р§д §г§С§Я§д§Ц§з§Я§Ъ§Ь§Ъ §Ь§С§Ь §е§б§Э§а§д§Я§Ъ§д§Ц§Э§о. §®§а§Ш§Я§а §д§С§Ь§Ш§Ц §Ъ§г§б§а§Э§о§Щ§а§У§С§д§о §Ъ §б§а§Э§а§г§Ь§е §г§д§Ц§Ь§Э§а§д§Ь§С§Я§Ъ. Ўм §©§С§Ф§в§е§Щ§Ь§С §Ъ §б§в§а§и§Ц§г§г §б§Ц§в§Ц§Ф§а§Я§Ь§Ъ §д§С§Ь§а§Ы §Ш§Ц. §§а§Я§г§д§в§е§Ь§и§Ъ§с §б§а§Э§е§й§Ъ§Э§С§г§о §а§й§Ц§Я§о §Ь§е§Э§о§д§е§в§Я§а§Ы §Ъ §б§в§С§Ь§д§Ъ§й§Я§а§Ы. §Ґ§а§б§а§Э§Я§Ц§Я§Ъ§Ц. §Ј§г§р §Ь§а§Я§г§д§в§е§Ь§и§Ъ§р §Я§С§Х§а §Х§Ц§Ы§г§д§У§Ъ§д§Ц§Э§о§Я§а §Я§С§Ф§в§Ц§У§С§д§о §Ю§Ц§Х§Э§Ц§Я§Я§а, §С §б§а §а§Ь§а§Я§й§С§Я§Ъ§Ъ §б§в§а§и§Ц§г§г§С §Ъ §а§д§Ь§Э§р§й§Ц§Я§Ъ§р §б§в§Ъ§Ц§Ю§Я§Ъ§Ь§С §а§г§д§С§У§Ъ§д§о §Т§С§Я§Ь§е §а§г§д§н§У§С§д§о §У §б§Ц§г§Ь§Ц (§Ь§С§Ь §д§е§д §е§Ш§Ц §Я§Ц§Ь§а§д§а§в§н§Ц §б§в§С§У§Ъ§Э§о§Я§а §Щ§С§Ю§Ц§д§Ъ§Э§Ъ).
ª §§а§Ц-§й§д§а §а §Ь§в§н§к§Ь§С§зЎ §°§Х§Ъ§Я §Ю§а§Ы §Щ§Я§С§Ь§а§Ю§н§Ы §Ъ§г§б§а§Э§о§Щ§е§Ц§д §Т§С§Я§Ь§е §Ъ§Щ-§б§а§Х §Ь§а§ж§Ц "§®§Ў§§§°§Ї§Ў" §г§а §г§д§Ц§Ь§Э§с§Я§Я§а§Ы §Ь§в§н§к§Ь§а§Ы. §Ј§Ц§в§Я§Ц§Ц, §Я§Ц §г§С§Ю§е §Т§С§Я§Ь§е, §С §Ь§в§н§к§Ь§е. §°§Я §б§в§Ъ§д§Ъ§в§С§Ц§д §Ц§Ч §Ь §б§а§Х§з§а§Х§с§л§Ц§Ы §Т§С§Я§Ь§Ц §г §б§а§Ю§а§л§о§р §Я§С§Ш§Х§С§й§Ь§Ъ. §°§г§д§С§Э§о§Я§а§Ц – §Ь§С§Ь §а§б§Ъ§г§С§Я§а §У§н§к§Ц. Составление материального и теплового балансов контактного узла Расчет выполнить на 1 т 60 % HNO 3.
Тепловым расчетом определить температуру, до которой необходимо нагреть аммиачно-воздушную смесь, чтобы процесс окисления аммиака протекал автотермично.
Материальный баланс Азотную кислоту получают окислением аммиака воздухом с последующей переработкой образующихся окислов азота. Окисление аммиака протекает на катализаторе по реакции: 4NH3+5O2=4NO+6H2O+904,8 кДж/моль (1) Одновременно с основной реакцией (1) идут побочные реакции, приводящие к дефиксации азота и выражающиеся суммарным уравнением: 4NH3+3O2→2N2+6H2O+1266,96 кДж/моль (2) 1. Вычисляем количество 100% азотной кислоты, содержащейся в 1 т 60% HNO3: m HNO3 =1000∙0,6=600 кг 2. Вычисляем количество аммиака, необходимое для производства 600 кг HNO3. Из балансового уравнения производства азотной кислоты NH3+2O2= HNO3+H2O (3) следует, что 1 кмоль HNO3 образуется из 1 кмоль NH3. Масса аммиака, необходимая для производства 600 кг HNO3, с учетом потерь составит:
где К1 – степень превращения аммиака в окись азота; К2 – степень абсорбции. Объем этой массы аммиака
3. Количество аммиачно-воздушной смеси (АВС), поступающей на окисление где В этом количестве АВС содержится воздуха:
4. Находим объемы поступающих с воздухом: кислорода (исходя из состава аммиачно-воздушной смеси)
Азота
5.Находим объемы и массы образующихся веществ: окиси азота по реакции (1):
паров воды по реакциям (1) и (2):
азота по реакции (2):
Всего азота в нитрозных газах:
|

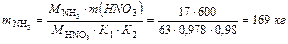

 ,
, – концентрация аммиака в аммиачно-воздушной смеси.
– концентрация аммиака в аммиачно-воздушной смеси.
 (или 466 кг).
(или 466 кг). (или 1632 кг).
(или 1632 кг).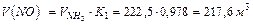 (291 кг)
(291 кг) (268 кг)
(268 кг)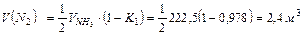
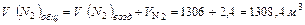 (1635,5 кг)
(1635,5 кг)


