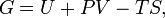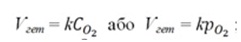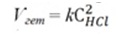Закон Гесса
1. Характеристика методів визначення масової частки вологи в харчових продуктах. Суть методів, їх переваги та недоліки Визначення загального вмісту вологи Висушування до постійної маси. Вміст вологи розраховують за різницею маси зразка до і після висушування у сушильній шафі при температурі 100-105°С. Це стандартний метод визначення вологи. Цей метод точний, але потребує багато часу для проведення аналізу. Визначення вільної і зв’язаної вологи Термогравіметричний метод оснований на визначенні швидкості висушування. В контролюємих умовах межа між областю постійної швидкості висушування і областю, де ця швидкість знижується, характеризує зв’язану вологу. Диференційна скануюча калориметрія. Якщо зразок охолодити до 0°С, то вільна волога замерзає, зв’язана – ні. При нагріванні замороженого зразка в калориметрі можна виміряти тепло, що витрачається при таненні льоду. Незамерзаюча вода визначається як різниця між загальною і замерзаючою водою. Ядерно-магнітний резонанс (ЯМР). Суть методу полягає у вивченні рухомості води в нерухомій матриці. При наявності вільної і зв’язаної вологи одержують дві лінії в спектрі ЯМР замість одної для об'ємної води.
ХАРЧОВІ КИСЛОТИ 1. Характеристика харчових кислот, які використовують як регулятори кислотності харчових систем Наявність ХК у продуктах може бути наслідком спеціального введення кислоти у харчову систему в ході технологічного процесу. У цьому випадку ХК використовуються у якості харчових добавок. Узагальнено можна виділити три основні цілі додавання кислот у харчову систему: ü надання необхідних органолептичних властивостей (смаку, кольору, аромату), характерних для конкретного продукту; ü вплив на колоїдні властивості, що обумовлюють консистенцію, що властива даному продукту; ü підвищення стабільності, що забезпечує збереження якості на протязі певного часу.
1) Оцтова кислота (С2Н4О2), Е260 – випускається у вигляді есенції, що містить 70-80% власної кислоти. У побуті використовують розбавлену оцтову есенцію, що називають "столовий оцет". Використовують для консервування харчових продуктів. В залежності від сировини, із якої одержують оцтову кислоту її розрізняють як винний, фруктовий, яблучний, спиртовий оцет. Одержують оцтову кислоту шляхом оцтовокислого бродіння. Солі і ефіри цієї солі називають ацетати. В якості харчових добавок використовують ацетати калію і натрію (Е261 і Е262). Оцтова кислота не має законодавчих обмежень; її дія основана на зниженні рН продукту, що проявляється при концентрації більше 0,5%; пригнічує дію бактерій. Область використання: овочеві консерви і мариновані продукти; використовуються у майонезах, соусах, при маринуванні овочів і рибної продукції, ягід, фруктів. Використовується і як смакова добавка. 2) Молочна кислота (С3Н6О3), Е270 – виробляється у двох формах: 40% розчин і концентрат який містить не менше 70% кислоти. Одержують молочнокислим бродінням цукрів. Її солі і ефіри називають лактатами. Використовують у виробництві безалкогольних напоїв, карамельних мас, кисломолочних продуктів. 3) Лимонна кислота (С6Н8О6), Е330 – продукт лимоннокислого бродіння цукрів. Солі і ефіри називають-цитрати. Використовують у кондитерській промисловості, при виробництві безалкогольних напоїв, та ін. 4) Яблучна кислота (С4Н6О5), Е296 – менш кисла, ніж лимонна. Одержують синтетичним шляхом із малеїнової кислоти. Солі і ефіри яблучної кислоти – малати. Використовують у кондитерській промисловості і при одержанні безалкогольних напоїв. 5) Винна кислота (С4Н6О6), Е334 – одержують із відходів виноробства. Солі і ефіри винної кислоти тартратами. Використовують у кондитерській і безалкогольній промисловості. 6) Бурштинова (янтарна) (С4Н6О4), Е363 – побічний продукт при одержанні адипінової кислоти. Відомий спосіб одержання із відходів бурштину. Використовують у харчовій промисловості для регулювання рН систем. 7) Адіпінова кислота (С6Н10О4), Е355 – одержують 2х стадійним окисленням циклогексана. Солі та ефіри називають адіпінати. Використовують у безалкогольній промисловості. 2. Харчові кислоти та їх вплив на якість продуктів. Харчові кислоти (ХК) – це різноманітна за своїми властивостями група речовин органічної і неорганічної природи. Склад і особливості хімічної будови ХК залежать від специфіки харчової сировини. Наприклад, кислотність молока і молочних продуктів формується за рахунок молочної кислоти, що утворюється в результаті біохімічних перетворень лактози молока. До групи органічних харчових кислот відносяться амінокислоти, вищі жирні кислоти. Іони водню обумовлюють кислий смак продукту. Активність іонів водню (активна кислотність) характеризується показником рН (від'ємний логарифм концентрації іонів водню).
Значення рН для деяких рідких харчових продуктів
Практично всі харчові кислоти є слабкі і у водних розчинах незначно дисоціюють. До того ж, в харчовій системі можуть знаходитись буферні речовини, в присутності яких активність іонів водню буде практично постійною. Прикладом такої системи є молоко. У зв’язку з цим, сумарна концентрація у харчовому продукті речовин, що мають кислий характер визначається показником потенційної, загальної чи титрованої (лугом) кислотності. Для різних продуктів ця величина виражається через різні показники. Наприклад, у соках визначають загальну кислотність в г на 1 л, в молоці в градусах Тернера, в борошні – в градусах Неймана.
Властивості харчових кислот
3. Вплив харчових кислот на якість продуктів. Харчові кислоти у складі продовольчої сировини і продуктів виконують різні функції, пов’язані з якістю харчових об’єктів. У складі комплексу смакоароматичних речовин вони беруть участь у формуванні смаку і аромату, які є основними показниками якості продукту. Саме смак, поряд із запахом і зовнішнім виглядом проявляють більш суттєвий вплив на вибір споживачем того чи іншого продукту у порівняні зі складом і харчовою цінністю. Зміни смаку і аромату проявляють ознаки початкового псування харчового продукту, або наявності в його складі сторонніх речовин. Смакове відчуття, яке визивається присутністю кислот у складі продукту – кислий смак, який пропорційний концентрації Н+. Наприклад, мінімальна концентрація смакового відчуття, що сприймається органом відчуттів, дозволяє сприйняти кислий смак для лимонної кислоти 0,017%, для оцтової 0,03%. У випадку органічних кислот на сприйняття кислого смаку впливають і аніони молекул. В залежності від природи останнього можуть виникати комбіновані смакові відчуття. Наприклад, лимонна кислота має кисло-солодкий смак, а пікринова – кисло-гіркий. Зміни смакових відчуттів відбуваються у присутності солей органічних кислот. Так, солі амонію надають продукту солоного смаку. Формування якості продукту здійснюється на усіх етапах технологічного процесу його одержання. При цьому багато технологічних показників, які забезпечують створення високоякісного продукту, залежать від активної кислотності (рН) харчової системи. В цілому величина рН впливає на слідуючі технологічні параметри: - утворення компонентів смаку і аромату, властивих для конкретного продукту; - колоїдну стабільність полідисперсної системи (наприклад колоїдний стан білків молока чи комплексу білково-дубильних з'єднань у пиві); - термічну стабільність харчової системи (наприклад термостійкість білкових речовин молочних продуктів); - біологічну стійкість (наприклад пива і соків); - умови росту корисної мікрофлори і її вплив на процеси дозрівання (наприклад пива чи сирів). 4. Роль харчових кислот у формуванні смаку та аромату продуктів. Вплив активної кислотності (рН) харчових систем на якість продуктів (питання №1) 5. Функції харчових кислот у складі харчових продуктів. Роль харчових кислот в організмі людини. Роль харчових кислот визначається їх участю у обміні речовин і їх енергетичною цінністю. Так, молочна кислота, яблучна та лимонна кислоти мають коефіцієнти енергетичної цінності: 3,6, 2,4, та 2,5 ккал/г відповідно. Але основна функція – участь у процесах травлення. До них відносяться: - активація перистальтики кишечника; - стимуляція секреції травних соків; - вплив на формування визначеного складу мікрофлори шляхом зниження рН середовища; - гальмування розвитку гнилісних процесів у товстому кишечнику. Наприклад, лимонна кислота перешкоджає утворенню в організмі канцерогенних нітрозамінників, сприяє зменшенню ризику виникнення і розвитку онкологічних патологій, сприяє засвоєнню організмом кальцію, активує чи інгібує діяльність деяких ферментів. Бензойна кислота має антисептичну дію. Але відомо, що щавлева кислота у вигляді кальцієвої солі здатна відкладатися у суглобах чи у вигляді каменів в сечовивідних шляхах. 6. Загальна характеристика харчових кислот. Вплив харчових кислот на кислотність продуктів (питання №1, 2) ОСНОВИ РАЦІОНАЛЬНОГО ХАРЧУВАННЯ 1. Теорії та концепції харчування В основі теорії збалансованого харчування лежить три головних положення. 1. При ідеальному харчуванні надходження речовин точно відповідає їх втратам. 2. Надходження харчових речовин забезпечується шляхом руйнації харчових структур і використання організмом утворених органічних і неорганічних речовин. 3. Енергетичні витрати організму повинні бути збалансовані з поступанням енергії. Згідно до цієї теорії, нормальне функціонування організму відбувається при його забезпеченні не тільки необхідною енергією і білком, але і при дотриманні визначених співвідношень між багаточисельними незамінними факторами харчування. Формула складена на загальну енергетичну цінність добової норми харчових речовин, що дорівнює 3000 ккал. Виходячи із формули збалансованого харчування повноцінний раціон повинен складатися з п’яти класів харчових речовин: - джерела енергії (білки, жири, вуглеводи); - незамінні амінокислоти; - вітаміни; - незамінні жирні амінокислоти; - неорганічні елементи. Вода не являється харчовою речовиною у прямому розумінні цього слова, але вона необхідна людині для поновлення втрат у різних процесах, наприклад при диханні, потовиділенні і інше. Збалансоване харчування пов’язано з урахуванням усіх факторів харчування, їх взаємозв’язку в обмінних процесах, а також відповідності ферментативних систем хімічним перетворення в організмі. У зв’язку з цим у 80-і роки ХХ сторіччя була сформульована нова теорія харчування з урахуванням новітніх знань про функції баластних речовин і кишкової мікрофлори у фізіології харчування. Основу раціонального харчування складають три головних принципи: 1.Баланс енергії, який передбачає адектваність енергії, що поступає з їжею, і енергії, що витрачається в процесах життєдіяльності. 2.Забезпечення потреб організму в оптимальних кількостях і співвідношеннях харчових речовин. 3.Режим харчування припускає дотримання певного часу і числа прийому їжі, а також раціонального розподілу їжі при кожному прийомі. 2. Основні принципи раціонального харчування. Перший принцип раціонального харчування Їжа для людини – джерело енергії. Енергію виражають у кілокалоріях (ккал) або у кілоДжоулях (кДж). Основними постачальниками енергії є макронутрієнти: білки, жири та вуглеводи. За енергетичною цінністю (калорійністю) харчові продукти діляться на 4 групи: 1. Особливо високо енергетичні: шоколад, жири, халва – 400-900 2. Високо енергетичні: борошно, крупа, макарони, цукор – 250-400 3. Середньоенергетичні: хліб, м'ясо, ковбаса, яйця, горілка – 100-250 4. Низькоенергетичні: молоко, риба, картопля, овочі, фрукти, пиво, біле вино – до 100 Енергетична цінність є однією із основних властивостей харчового продукту, що визначає його харчову цінність. Основний обмін – це мінімальна кількість енергії, яка необхідна людині для підтримання життя у стані повного покою (під час сну у комфортних умовах). Перетравлювання їжі також потребує енергії. Найбільші витрати енергії потрібні для перетравлювання білкової їжі, найменші – для перетравлювання вуглеводів. Вважається, що при оптимальній кількості споживаємих речовин витрати складають 140 – 160 ккал на добу. М’язова діяльність визначається активністю способу життя людини, яка залежить від фізичної активності і характеру роботи. В середньому на м’язову діяльність потрібно щоденно 100-2500 ккал. Для забезпечення нормальної життєдіяльності людини необхідно створити умови відносної рівноваги між енергією, яку людина витрачає, і енергією, яку вона одержує з їжею. Баланс енергії означає співвідношення між спожитою енергією і витраченою. Другий принцип раціонального харчування У відповідності з другим принципом раціонального харчування, повинні бути забезпечені потреби організму в основних харчових речовинах, які включають джерела енергії (білки, жири, вуглеводи), незамінні амінокислоти, незамінні вищі жирні кислоти, вітаміни, мінеральні речовини. Жири являються високоефективним джерелом енергії (9ккал/г), а також джерелом вуглецевих атомів у біосинтезі холестерину і інших стероїдів, джерелом незамінних жирних кислот. Третій принцип раціонального харчування В основу третього принципу раціонального харчуванн6я закладено чотири основних правила: ü регулярність харчування; ü дробність харчування на протязі доби, яка повинна складати не менше 3-4 разів на день; ü раціональний підбір продуктів при кожному прийомі; ü оптимальне розподілення їжі на протязі дня, при якому вечеря не повинна перевищувати третини денного раціону. Добовий розподіл харчового раціону (в%)
Продукти, що містять білки тваринного походження, раціональніше вживати у першій половині дня, а молочну і рослинну їжу – у другій. 3. Харчова цінність продукту. Головні функції, на які витрачається енергія організму людини. Харчова цінність продукту – сукупність властивостей харчового продукту, при наявності яких задовольняються фізіологічні потреби людини в необхідних речовинах і енергії. Енергія, якою забезпечується організм при вживанні і засвоюванні поживних речовин, витрачається на здійснення трьох головних функцій, пов’язаних із життєдіяльністю організму. До них відносяться основний обмін, перетравлювання їжі, м’язову діяльність. 4. Роль ліпідів в організмі людини Добова потреба організму у жирах складає 60-80г, що відповідає 30-35% від загальної енергетичної цінності. Оптимальне співвідношення рослинних і тваринних жирів складає 7:3, тобто на долю тваринних жирів у денному раціоні повинно приходитись 30, а на долю рослинних 70%. Таке співвідношення забезпечує поступання різних видів вищих жирних кислот у процесі травлення у пропорціях: 30% - насичених, 60% - мононенасичених, 10% - поліненасичених, що є оптимальним з позиції раціонального харчування. Відхилення на протязі тривалого часу вмісту жирів у денному раціоні від оптимального сприяє розвитку атеросклерозу і ішемічної хвороби серця. Фізіологічно цінними компонентами ліпідної природи є фосфоліпіди, які необхідні для поновлення клітин і внутріклітинних структур. Добова потреба організму у фосфоліпідах складає 5г. Білки, що поступають з їжею, виконують три основні функції: 1) Білки – джерела 8 незамінних і 12 замінних амінокислот, які використовуються в якості будівельних блоків у ході біосинтезу білка не тільки у дітей (в т.ч. новонароджених), але і у дорослих, забезпечуючи постійне поновлення білків і їх кругообіг. 2) Амінокислоти служать попередниками гормонів, порфіринів інших біомолекул. 3) Окиснення вуглецевого скелета амінокислот призводить до загальних витрат енергії. 5. Значення білків у життєдіяльності людини Добова потреба у білках 85-90г. Показник якості харчового білка, що відображає ступінь відповідності його амінокислотного складу потребам організму в амінокислотах для синтезу білка, має назву біологічна цінність. Самими повноцінними є білки тваринного походження, поскільки вони містять незамінні амінокислоти у кількості, наближеній до ідеального білка. Для нормального харчування кількість незамінних амінокислот повинна складати 36-40%, що забезпечується при співвідношенні білків рослинних і тваринних, як 45:55%. 6. Принципові положення адекватного харчування. Значення харчових волокон для організму людини Автор теорії – російський фізіолог академік А.М. Уголєв. Теорія була названа – теорією адекватного харчування. В основі теорії лежать чотири принципових положення: 1) Їжа засвоюється як організмом, так і населеними бактеріями. 2) Надходження нутрієнтв у організм забезпечується за рахунок вивільнення їз їжі і в результаті діяльності бактерій, що синтезують поживні речовини. 3) Нормальне харчування обумовлюється не одним а декількома потоками поживних і регуляторних речовин. 4) Фізіологічно важливими компонентами їжі є баластні речовини, які одержали назву «харчові волокна». Теорія адекватного харчування формулює основні принципи, що забезпечують раціональне харчування. В якому враховано весь комплекс факторів харчування, взаємозв’язки цих факторів у процесах обміну і відповідності ферментних систем організму індивідуальним особливостям хімічних перетворень, що протікають у ньому. Специфічні фізіологічні властивості харчових волокон наступні: 1) Стимуляція кишкової перистальтики. 2) Адсорбція різних токсичних продуктів, у т.ч. продуктів неповного перетравлення, радіонуклідів, деяких канцерогенних речовин. 3) Зменшення доступності макронутрієнтів (жирів і вуглеводів) дії харчо травильних ферментів, попереджуючих різке підвищення їх вмісту у крові. 4) Доступність дії кишкової мікрофлори (у якості постійного живильного субстрату), діяльність якої забезпечує поступання в організм цінних вторинних нутрієнтів (вітамінів гр.. В і інш.) і проявляється у різних інших позитивних ефектах впливу на обмін речовин. Функції розчинних і нерозчинних харчових волокон різні: целюлози і геміцелюлози стимулюють перистальтику кишечника, а пектини є сорбентами і живильним субстратом для кишкової мікрофлори. 7. Біологічна ефективність. Біологічна цінність. Потреби організму людини в основних складових їжі. Регулярність харчування пов’язана з дотриманням часу приймання їжі, при якому у людини формується рефлекс виділення харчотравних соків, що забезпечує нормальне харчотравлення і засвоєння їжі. Дробність харчування забезпечує рівномірне навантаження на харчотравильний апарат і створює умови для своєчасного забезпечення організму необхідною енергією і поживними речовинами. Продукти, що містять білки тваринного походження, раціональніше вживати у першій половині дня, а молочну і рослинну їжу – у другій. Оптимальний розподіл їжі на протязі дня диференціюється в залежності від віку, характеру фізичної активності, розпорядку дня. Для людей середнього віку найбільш раціональним прийнято чотириразове харчування; для похилих людей – п’ятиразове з проміжками між прийомами в 4-5 год. Менш раціональним вважається триразове харчування, при якому збільшується об’єм спожитої їжі і навантаження на харчотравильний апарат. Офіційна статистика свідчить про тенденцію до збільшення числа прийомів їжі на протязі дня. Наприклад, у французів кількість денних прийомів їжі виросло сьогодні до 6, а у деяких американців до 20. Ці тенденції спричинили зміни в упаковці продуктів: збільшилась чисельність мілкої упаковки, з’явилась продукція придатна до вживання, що дає можливості «переїсти» в любий час в любому місці. Закон Гесса В основі термохімічних розрахунків лежить закон Гесса: Тепловий ефект (ΔН) хімічної реакції (при постійних Р і Т) залежить від природи і фізичного стану вихідних речовин та продуктів реакції і не залежить від шляху її протікання. Наслідки із закону Гесса: 1. Теплові ефекти прямої і зворотної реакцій рівні за величиною і протилежні за знаком. 2. Тепловий ефект хімічної реакції (ΔН) дорівнює різниці між сумою ентальпій утворення продуктів реакції та сумою ентальпій утворення вихідних речовин, взятих з урахуванням коефіцієнтів у рівнянні реакції (тобто помножені на них). Закон Гесса може бути записаний у вигляді наступного математичного виразу:
За допомогою закону Гесса можна розрахувати ентальпії утворення речовин і теплові ефекти реакцій, які неможливо виміряти експериментально. 1.3. Закон Кірхгофа Закон Кірхгофа встановлює залежність теплового ефекту хімічної реакції від температури: температурний коефіцієнт теплового ефекту хімічної реакції дорівнює зміні теплоємності системи в ході реакції. Закон Кірхгофа лежить в основі розрахунку теплових ефектів при різних температурах.
4. Закон Гесса дозволяє обчислити теплові ефекти процесів, для яких відсутні експериментальні дані. Це стосується не тільки хімічних реакцій, але й процесів розчинення, випарювання, сублімації, кристалізації та ін. При термохімічних розрахунках особливо значимі два види теплових ефектів: ентальпія утворення та ентальпія горіння сполук. Ентальпія утворення сполук є тепловим ефектом реакції утворення одного моля даної сполуки із простих речовин за стандартних умов. Наприклад, стандартна ентальпія утворення DfН карбонату кальцію – це тепловий ефект реакції Са(т) + С(графіт) + 1,5О2(г) = СаСО3(т), DfН = - 1206 кДж.
При цьому ентальпія утворення простих речовин (Н2, О2, Са, С та ін.) дорівнює нулю, а ентальпії утворення більшості відомих речовин можна відшукати у довідниках. За значною кількістю стандартних ентальпій утворення можна обчислити теплові ефекти багатьох хімічних реакцій. При цьому використовують правило, яке випливає із закону Гесса: тепловий ефект хімічної реакції дорівнює різниці суми ентальпій утворювання кінцевих речовин та суми ентальпій утворювання вихідних речовин із урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
Нехай хімічна реакція проходить відповідно до рівняння аА + bВ = сС + dD DН -?
Тут а, b, с, d –коефіцієнти перед речовинами А, В, С, D.Тоді DН = (сDfНС + dDfНD) – (aDfНA + bDfНB). Для наочності розглянемо конкретний приклад. Реакцію горіння етану С2Н6 описується рівнянням С2Н6(г) + 3,5О2(г) = 2СО2(г)+3Н2О(ж), DН298 =-1559,87 кДж/моль. Обчислити ентальпію утворення етану, якщо відомі ентальпії утворення вуглекислого газу та води: DfН298(СО2)= -393,51 кДж/моль, DfН298 (Н2О) = - 285,84 кДж/моль. Відповідно до закону Гесса маємо: DН = 2DfН(СО2) + 3DfН(Н2О) - DfН(С2Н6). Звідси DfН298(С2Н6) = 2DfН298(СО2) + 3DfН298(Н2О) - DН298 ==2(-393,51) + 3(-285,84) – (-1559,87) = -84,67 кДж/моль. Ентальпією згоряння сполуки називають тепловий ефект реакції окислення даної сполуки киснем за стандартних умов з утворенням вищих оксидів елементів, що входять до складу цієї сполуки. Наприклад, стандартна ентальпія згоряння DСН етилового спирту – це тепловий ефект реакції С2Н5ОН(ж) + 3О2 = 2СО2(г) + 3Н2О(ж). Продуктами сгоряння є СО2, Н2О(г) або Н2О(ж), SO3 та інші. Якщо серед продуктів реакції крім оксидів, наявні інші речовини (наприклад, N2, HCl), то це спеціально обумовлюється. Ентальпії згоряння вищих оксидів та інших продуктів сгоряння, а також кисню брати за нуль. За допомогою ентальпій згоряння можна також розрахувати теплові ефекти хімічних реакцій, використовуючи таке правило: тепловий ефект хімічної реакції дорівнює різниці суми ентальпій згоряння вихідних речовин та сумі ентальпій згоряння продуктів реакції з урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
5.Дру́гий закон термодина́міки — один із основних законів фізики, закон про неспадання ентропії візольованій системі. Він накладає обмеження на кількість корисної роботи, яку може здійснити тепловий двигун. На засадничому рівні другий закон термодинаміки визначає напрямок протікання процесів у фізичній системі - від порядку до безпорядку. Існує багато різних формулювань другого закону термодинаміки, загалом еквівалентних між собою. ля системи із сталою температурою існує певна функція стану S — ентропія, яка визначається таким чином, що 1. Адіабатичний перехід із рівноважного стану A в рівноважний стан B можливий лише тоді, коли
2. Приріст ентропії у квазістаціонарному процесі дорівнює
де T — температура. Формулюваняя: Неможливо перетворити теплоту в роботу, не виконуючи ніякої іншої дії крім охолодження системи Вільна енергія Гіббса (або просто енергія Гіббса, або потенціал Гіббса, або термодинамічний потенціал у вузькому сенсі) - це величина, що показує зміну енергії в ході хімічної реакції і дає таким чином відповідь на принципову можливість протікання хімічної реакції; це термодинамічний потенціал такого вигляду:
Второй закон термодинамики объясняет направление протекания процессов и вводит понятие энтропии ΔS=Q/T. Критерием самопроизвольного протекания процесса в изолированной системе является ΔS>0, равновесия – ΔS=0. 2. Энтропия является функцией состояния и ее смысл расшифровывается в статистической термодинамики как мера беспорядка системы. Чем больше беспорядок, тем больше энтропия. 3. Критериями самопроизвольного протекания процессов при p, T=const является ΔG<0; V, T=const - ΔF<0. Критериями равновесия – ΔG=0 при p, T=const и ΔF=0 при V, T=cons (термодинамическую вероятность) протекания процесса. При реальном предсказании возможности протекания процесса надо учитывать еще и скорость его протекания
6.Хімічна рівновага - стан хімічної системи, в якому оборотно протікає одна або кілька хімічних реакцій, причому швидкості в кожній парі пряма-зворотна реакція рівні між собою. Для системи, що перебуває в хімічному рівновазі, концентрації реагентів, температура і інші параметри системи не змінюються з часом.[1] А 2 + В 2 ⇄ 2AB 1. Зміщення хімічної рівноваги Положення хімічної рівноваги залежить від наступних параметрів реакції: температури, тиску і концентрації. Вплив, який чинять ці фактори на хімічну реакцію, підпорядковуються закономірності, яка була висловлена в загальному вигляді в 1885 французьким ученим Ле-Шательє. Фактори що впливають на хімічну рівновагу: 1) температура При збільшенні температури хімічна рівновага зміщується в бік ендотермічний (поглинання) реакції, а при зниженні в сторону екзотермічної (виділення) реакції. CaCO3 = CaO + CO2-Q t ↑ →, t ↓ ← N2 +3 H2 ↔ 2NH3 + Q t ↑ ←, t ↓ → 2) тиск При збільшенні тиску хімічна рівновага зміщується в бік меншого обсягу речовин, а при зниженні в бік більшого об'єму. Цей принцип діє тільки на гази, тобто якщо в реакції беруть участь тверді речовини, то вони в розрахунок не беруться. CaCO3 = CaO + CO2 P ↑ ←, P ↓ → 1моль = 1моль +1 моль 3) концентрація вихідних речовин та продуктів реакції При збільшенні концентрації одного з вихідних речовин хімічна рівновага зміщується в бік продуктів реакції, а при збільшенні концентрації продуктів реакції-убік вихідних речовин. S2 +2 O2 = 2SO2 [S], [O] ↑ →, [SO2] ↑ ← Каталізатори не впливають на зміщення хімічної рівноваги! До екзергонічних реакцій належать катаболічні реакції - реакції розщеплення або окиснення “паливних” молекул (енерговмісних нутрієнтів), котрі надходять в організм у складі харчових продуктів. До ендергонічних реакцій належать анаболічні реакції - реакції синтезу складних біоорганічних сполук – клітинних макромолекул. В біології міцно закріпилось уявлення, що дихання в організмі (окиснення) за своєю суттю є процесом “горіння", яке відбувається дуже повільно. Отже, поживні речовини, що потрапили в організм з їжею, є “паливом", яке згорає в організмі шляхом приєднання кисню повітря. Разом з тим, було звернуто увагу на той факт, що повільне “горіння" органічних речовин в організмі істотно відрізняється від такого, що проходить поза організмом: по-перше, воно відбувається при низькій температурі, по-друге, – при відсутності полум'я і, по-третє, – за наявності води, вміст якої в тканинах досить високий. Біологічне окиснення – це сума всіх окисно-відновних процесів, включаючи анаеробні, що відбуваються в клітинах організму (цитоплазмі, мітохондріях, ендоплазматичному ретикулумі). Основними субстратами біологічного окиснення є вуглеводи та ліпіди, саме їх катаболізм дає найбільшу кількість хімічної енергії, що акумулюється у високоенергетичних зв’язках макроергів. Функції біологічного окиснення: 1. Забезпечення клітин енергією; 2. Забезпечення клітин пластичним матеріалом для відтворення структур організму; 3. Знешкодження токсичних речовин.
7. Залежність швидкості реакції від концентрації реагуючих речовин. Залежність швидкості реакції від концентрації реагуючих речовин виражається основним законом хімічної кінетики – законом діючих мас (ЗДМ): швидкість гомогенної хімічної реакції за постійної температури прямо пропорційна добутку концентрацій реагуючих речовин, узятих в степенях їхніх стехіометричних коефіцієнтів в рівнянні реакції. Для реакції aA + bB = cC + dD математичний вираз закону запишеться так: Ѵгом = kСАа×СВb, (5.1) де Ѵгом – швидкість реакції; k – константа швидкості хімічної реакції; САа і СВb – концентрації реагуючих речовин, моль/л; а, b – стехіометричні коефіцієнти в рівнянні реакції. Фізичний зміст константи швидкості (k): k показує, з якою швидкістю відбувається реакція за концентрацій реагуючих речовин 1 моль/л. Константа швидкості залежить від природи реагуючих речовин, температури, присутності каталізатора, але не залежить від концентрації реагуючих речовин і парціальних тисків (для газів). Для реагуючих речовин в газоподібному стані замість концентрацій в законі діючих мас можна використати їх парціальні тиски: Ѵгом = k×рАа×рВb. (5.2) У разі гетерогенних процесів в закон діючих мас входять концентрації тільки тих речовин, які знаходяться в газовій фазі або розчині. Концентрації речовин, що знаходяться в твердій фазі, постійні і включені в константу швидкості. Наприклад: C(т) + О2(г) = СО2(г) Zn(т) + 2HCl(ж) = ZnCl2(ж)+ H2(г)
константою рівноваги хімічної реакції називається добуток рівноважних концентрацій кінцевих речовин, поділений на добуток рівноважних концентрацій початкових речовин, причому всі концентрації взяті у ступенях, які однакові із стехіометричними коефіцієнтами реакції. Константа рівноваги не залежить від концентрацій початкових і кінцевих речовин, але залежить від природи речовин і температури. якщо на систему, що перебуває в стані рівноваги, чиниться який-небудь зовнішній вплив (змінюється концентрація, температура, тиск), то він сприяє перебігу тієї з двох протилежних реакцій, яка послаблює цей вплив. якщo нa cucmeмy, щo nepeбyвaє y cmaнi piвнoвaгu, noдiяmu ззoвнi, mo в cucmeмi вiдбyвamимymьcя змiнu, щo nocлaблююmь абo знuщyюmь цю дiю. Poзглянeмo вплив piзниx чинникiв нa cтaн xiмiчнoї piвнoвaги.
|

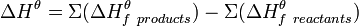 .
.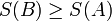 .
.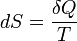 ,
,