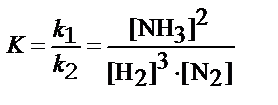Константа хим равновесия.
в случае обратимой реакции одновременно идут «прямая» и «обратная» реакция, скорость «прямой» реакции большая, пока концентрация исходных в-в высокая, а продуктов реакции низкая, с уменьшением концентрации исходных в-в и увеличения концентрации продуктов реакции скорость «обратной» реакции растет, а скорость «прямой» снижается
u
t
в некоторый момент скорости уравниваются, и наступает равновесие хим.равновесие – состояние системы реагирующих в-в, где скорости «прямой» и «обратной» реакций равны ПР: СН3СООН Û H+ + СН3СОО- u 1= k 1 С (СН3СООН) u 2= k 2 С (H+) С (СН3СОО-) u 1 =u 2 k 1 С (СН3СООН) = k 2 С (H+) С (СН3СОО-) k 1[СН3СООН] = k 2[H+][СН3СОО-]
, где K – константа равновесия реакции диссоциации или константа диссоциации
ПР: N2 + 3Н2 Û 2NH3 + Q u 1= k 1 С 3 (Н2) С (N2) u 2= k 2 С 2 (NH3) u 1 =u 2 k 1 С 3 (Н2) С (N2) = u 2= k 2 С 2 (NH3) k 1 С 3 [Н2] С [N2] = u 2= k 2 С 2 [NH3]
, где K – константа хим.равновесия
при хим.равновесии энергия Гиббса не меняется D G = 0 если задать равновесные концентрации в-в и рассчитать константу равновесия K, то можно определить возможность такого равновесия по уравнению изобарно-изотермного потенциала хим.р-ции или по уравнению изотермы хим.реакции 41)У равнение изотермы хим. Реакции. D G = - RT × ln K = -2,3 RT × lg K = -1,418 T × lg K самопроизвольный термодинамический процесс пойдет в сторону уменьшения энергии Гиббса D G < 0: если D G < 0, то идет хим.реакция если D G = 0, то есть хим.равновесие если D G > 0, то хим.реакция самопроизвольно идет в обратном направлении или хим.реакция идет в прямом направлении, но требует внешнего источника энергии
42) Принцип Ле-Шателье. при хим.равновесии концентрации в-в не меняются, но хим.реакции продолжаются(динамическое равновесие), положение хим.равновесия смещается, если меняются условия(температура, давление газов, концентрация в-в…), при этом концентрации всех в-в меняются до тех пор, пока не устанавливается новое хим.равновесие *Ле-Шателье внешнее воздействие на систему смещает хим.равновесие в сторону реакции, ослабляющей это воздействие влияние изменения концентрации в равновесной системе нельзя изменить концентрацию одного в-ва, не вызывая изменения концентрации других при увеличении концентрации в-ва ускорится реакция, уменьшающая концентрацию этого в-ва влияние изменения температуры при повышении температуры ускорится и «прямая», и «обратная» реакции, но в разной степени: эндотермическая реакция ускорится в большей степени, чем экзотермическая, при понижении температуры замедлится и «прямая», и «обратная» реакции, но в разной степени: эндотермическая реакция замедлится в большей степени, чем экзотермическая влияние изменения давления условия: реагируют в-ва-газы, и реакция сопровождается изменением давления газов при повышении давления ускорится реакция, идущая с уменьшением давления влияние катализаторов катализаторы ускоряют и «прямую», и «обратную» реакции и не смещают хим.равновесие ПР: 2SO 2 + O 2 Û 2SO 3 + Q 2SO2 + O2 ® 2SO2 и выделение тепла 3 моля 2 моля реакция идет с ¯ р - при повышении давления газов реакция ускорится, реакция идет с выделением тепла - при дополнительном охлаждении реакция ускорится
2SO3 ® 2SO2 + O2 и поглощение тепла 2 моль 3 моля реакция идет с р - при повышении давления газов реакция замедлится, реакция идет с поглощением тепла - при дополнительном охлаждении реакция замедлится__________ для смещения равновесия в сторону синтеза SO3 нужно охлаждать систему и повышать давление газов.
|