Внутренняя энергия идеального газа -физ.величина, численно равная сумме кинетических энергий идеального газа. Микроскопическая система-описывает каждую молекулу газа(масса,скорость,концентрация).Макроскопическая система-описывает сразу весь газ(давление
,объем,абсолютная температура газа)
Распределение Максвелла:все молекулы движутся с одной и той же скоростью, на самом деле это не так, но большинство молекул движутся с близкими скоростями. Молекул, которые движутся очень быстро(медленно), очень мало.
График имеет ярко выраженный максимум. Скорость, с которой движется большая часть молекул, называется более вероятной скоростью 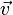 , или со скоростью, близкими к ней. Распределение молекул по скоростям зависит от температуры, если ее увеличить, то вероятная скорость возрастет(и наоборот). Т2>Т1. Площадьпод графиком осталась прежней. Она численно равна полному числу молекул и при повышении Т в сосуде не меняется, следовательно, площадь неизменна. Уравнение:
, или со скоростью, близкими к ней. Распределение молекул по скоростям зависит от температуры, если ее увеличить, то вероятная скорость возрастет(и наоборот). Т2>Т1. Площадьпод графиком осталась прежней. Она численно равна полному числу молекул и при повышении Т в сосуде не меняется, следовательно, площадь неизменна. Уравнение:
ΔN/N~ 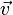 ² е(в степени -m
² е(в степени -m 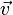 ²/2KT)*Δ
²/2KT)*Δ 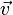
Δ 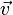 - диапазон скоростей, ΔN-число молекул, попадающих в этот диапазон,
- диапазон скоростей, ΔN-число молекул, попадающих в этот диапазон, 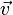 - средняя скорость Δ
- средняя скорость Δ 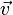 ,е-величина,называемая основанием натурального логарифма е=2,718281828, m-масса молекул, К- постоянная Больцмана (R/Na=K). пропорциональность. Колоколообразный вид графика определяется е(в степени -m
,е-величина,называемая основанием натурального логарифма е=2,718281828, m-масса молекул, К- постоянная Больцмана (R/Na=K). пропорциональность. Колоколообразный вид графика определяется е(в степени -m 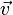 ²/2KT), функции такого вида- ф-ции Гаусса: у= е(в степени –х). в физике гауссовская ф-ция возникает всегда, когда имеет место случайная зависимость одной величины от другой. Скорость молекул так же случайна. Молекулы газа вследствие теплового движения испытывают многочисленные соударения друг с другом. При каждом соударении скорости молекул изменяются как по величине, так и по направлению.
²/2KT), функции такого вида- ф-ции Гаусса: у= е(в степени –х). в физике гауссовская ф-ция возникает всегда, когда имеет место случайная зависимость одной величины от другой. Скорость молекул так же случайна. Молекулы газа вследствие теплового движения испытывают многочисленные соударения друг с другом. При каждом соударении скорости молекул изменяются как по величине, так и по направлению.

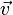 , или со скоростью, близкими к ней. Распределение молекул по скоростям зависит от температуры, если ее увеличить, то вероятная скорость возрастет(и наоборот). Т2>Т1. Площадьпод графиком осталась прежней. Она численно равна полному числу молекул и при повышении Т в сосуде не меняется, следовательно, площадь неизменна. Уравнение:
, или со скоростью, близкими к ней. Распределение молекул по скоростям зависит от температуры, если ее увеличить, то вероятная скорость возрастет(и наоборот). Т2>Т1. Площадьпод графиком осталась прежней. Она численно равна полному числу молекул и при повышении Т в сосуде не меняется, следовательно, площадь неизменна. Уравнение:


