Секвенирование ДНК
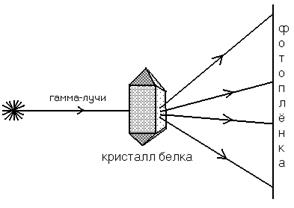
Первичная структура любой белковой молекулы напрямую зависит от структуры ДНК-генома. Поэтому сначала выделяют ген, в котором закодирована структура белка. Далее определяют последовательность азотистых оснований в ДНК. Каждая аминокислота в белковой молекуле закодирована сочетанием трех азотистых оснований - триплетом (кодоном) в молекуле ДНК. Например, сочетание трех оснований аденина (ААА) кодирует аминокислоту фенилаланин, а последовательность из трех оснований цитозина – глицин. Это дает возможность получить информацию о первичной структуре белковой молекуле, а, значит, прогнозировать строение всей молекулы в целом, поскольку именно первичная структура определяет строение всех высших уровней организации – и вторичной, и третичной, а, иногда и четвертичной структур. Для проверки предположений о строении высших структур используется еще один метод: Рентгеноструктурный анализ Схема, поясняющая принцип этого метода, представлена на рисунке:
В результате облучения на фотопленке фиксируется карта электронной плотности (похожа на географическую карту). Далее производится компьютерный анализ полученного изображения, в результате чего строится пространственная модель белковой молекулы. Электронная микроскопия Может быть использована для выяснения структуры белковых молекул с большой молекулярной массой – от 500.000 до 1.000.000 Да (дальтон). Дальтон (Да) и килодальтон (кДа) – единицы измерения массы белков. 1кДа=103 Да. 1 дальтон равен 1/16 массы атома кислорода (кислородная единица массы).
КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ Из всего сказанного можно заключить, что пространственная организация белков очень сложна. В химии существует понятие - пространственная КОНФИГУРАЦИЯ - жестко закрепленное ковалентными связями пространственное взаимное расположение частей молекулы (например: принадлежность к L-ряду стереоизомеров или к D-ряду). Для белков также используется понятие КОНФОРМАЦИЯ белковой молекулы - определенное, но не застывшее, не неизменное взаимное расположение частей молекулы. Так как конформация белковой молекулы формируется при участии слабых типов связей, то она является подвижной (способной к изменениям), и белок может изменять свою структуру. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят друг в друга. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой молекулы. Это обратимые конформационные изменения (встречаются в организме, например, при проведении нервного импульса, при переносе кислорода гемоглобином). При изменении конформации часть слабых связей разрушается, и образуются новые связи слабого типа.
|