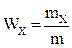Выбор метода зависит и от того, какое количество образцов необходимо проанализировать.
. Выбор метода осложняется, если анализируемый объект содержит много сопутствующих элементов в различных количественных соотношениях. Приходится учитывать химическую природу сопутствующих элементов, их количество и близость свойств с определяемым компонентом. Для достижения требуемой точности большое значение имеют метрологические характеристики метода анализа: интервал определяемых концентраций, селективность, правильность, воспроизводимость и др. Точность результата анализа зависит не только от стадий градуировки и измерения аналитического сигнала, но и от стадий отбора средней пробы и подготовки пробы к анализу. Вклад пробоотбора в общую погрешность анализа не выявляется обычными приемами – проведением контрольного (холостого) определения, использованием стандартных образцов и т.п. Моль равен количеству вещества системы, содержащей столько же элементарных объектов, сколько атомов содержится в 12 г изотопа углерода 12С. Чтобы узнать это число атомов, нужно 12 г разделить на массу атома изотопа углерода 12С, выраженную в граммах: В ходе анализа находят массу или количество вещества определяемого компонента в пробе. Разделив массу определяемого компонента на объем пробы, получают значение физической величины, называемой массовой концентрацией:
При делении количества вещества определяемого компонента на объем пробы получают значение физической величины, называемой молярной концентрацией:
При делении массы определяемого компонента на массу пробы и количества вещества определяемого компонента на сумму количеств веществ всех компонентов пробы получают значения безразмерных физических величин, называемых массовой и молярной долями соответственно:
Молярную и массовую доли часто выражают в процентах (%), в промилле (о/оо), в миллионных долях (млн-1 или ppm в англоязычной литературе) и в миллиардных долях (млрд-1 или ppb в англоязычной литературе). Таблица 1.2. Особенности обозначения физических величин
Химический эквивалент – реальная или условная химическая частица, эквивалентная одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Таблица 1.3 Наименования и обозначения физических величин при применении закона эквивалентов
В последние десятилетия в аналитическом контроле основную роль стали играть физические, главным образом спектрометрические методы, хотя классические химические методы не потеряли своего значения в обеспечении метрологического единства аналитических измерений в целом. Список рекомендуемой литературы 1. Основы аналитической химии. В 2-х книгах. Учебник для вузов. Под ред. Ю.А.Золотова. – 3-е изд., перераб. и доп. – М.: Высшая школа, 2004. 2. Отто М. Современные методы аналитической химии. – 2-е исправленное издание. – Москва: Техносфера, 2006.
|

 Полученное число носит название числа Авогадро и обозначается NA.
Полученное число носит название числа Авогадро и обозначается NA.
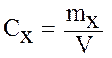 (1.5)
(1.5) (1.6)
(1.6) (1.7)
(1.7) (1.8)
(1.8)