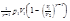| Обозн.
| Изм.
| Смысл
|
| p
| Па
| давление
|
| V
| м3
| объем
|
| T
| К
| температура
|
| N
| –
| число молекул
|
| m
| кг
| масса
|

| кг/Моль
| молярная масса
|

| Моль
| кол-во вещества
|
| U
| Дж
| вн. энергия газа
|
| Q
| Дж
| кол-во теплоты
|
|
| –
| КПД
|
Уравнение состояния.
pV=NkT - уравнение состояния (уравнение Менделеева- Клайперона)
 ,
,  ,
,  ;
;
 ,
,  - полная внутренняя энергия системы.
- полная внутренняя энергия системы.
| Число атомов
| i
| 
|
|
|
| 5/3
|
|
|
| 9/7
|
|
| 13 (12)
| 15/13 (7/6)
|
 - основное уравнение молекулярно- кинетической теории.
- основное уравнение молекулярно- кинетической теории.
 - закон Дальтона для давления смеси газов.
- закон Дальтона для давления смеси газов.
 , p=nkT;
, p=nkT;
при N=const 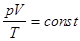
| T=const
| изотерма
| PV=const
| закон Бойля-Мариотта
|
| p=const
| изобара
| V/T=const
| закон Гей-Люсака
|
| V=const
| изохора
| p/T=const
| закон Шарля
|
Броуновское движение.
 среднеквадратичная скорость молекул.
среднеквадратичная скорость молекул.
 - наиболее вероятная скорость молекул.
- наиболее вероятная скорость молекул.
 - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул.
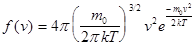 - Закон Максвелла для распределения молекул идеального газа по скоростям.
- Закон Максвелла для распределения молекул идеального газа по скоростям.
Среднее число соударений молекулы за 1с: 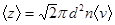
Средняя длинна свободного пробега молекул 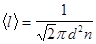
 - средний путь молекулы за время t.
- средний путь молекулы за время t.
Распределение в потенциальном поле.
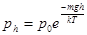 - барометрическая формула.
- барометрическая формула.
 - распределение Больцмана.
- распределение Больцмана.
Термодинамика.
 - первое начало термодинамики.
- первое начало термодинамики.
 - работа газа.
- работа газа.
 - уравнение адиабаты.
- уравнение адиабаты.
Теплоемкость  , удельная теплоемкость с=С/m.
, удельная теплоемкость с=С/m.
| Название
| Опред.
| Уравнение
| A
| Q
| C
|
| Изохора
| V=const
| Q=U
| 0
| NkT/(-1)
| Nk/(-1)
|
| Изобара
| p=const
| U=Q+pV
| pV
| pV/(-1)
| Nk/(-1)
|
| Изотерма
| T=const
| Q=A
| 
| A
|
|
| Адиабата
| Q=const
| U=-A
| 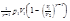
| 0
| 0
|



 ,
,  ,
,  ;
; ,
,  - полная внутренняя энергия системы.
- полная внутренняя энергия системы.
 - основное уравнение молекулярно- кинетической теории.
- основное уравнение молекулярно- кинетической теории. - закон Дальтона для давления смеси газов.
- закон Дальтона для давления смеси газов. , p=nkT;
, p=nkT;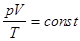
 среднеквадратичная скорость молекул.
среднеквадратичная скорость молекул. - наиболее вероятная скорость молекул.
- наиболее вероятная скорость молекул. - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул.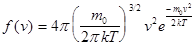 - Закон Максвелла для распределения молекул идеального газа по скоростям.
- Закон Максвелла для распределения молекул идеального газа по скоростям.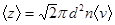
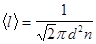
 - средний путь молекулы за время t.
- средний путь молекулы за время t.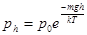 - барометрическая формула.
- барометрическая формула. - распределение Больцмана.
- распределение Больцмана. - первое начало термодинамики.
- первое начало термодинамики. - работа газа.
- работа газа. - уравнение адиабаты.
- уравнение адиабаты. , удельная теплоемкость с=С/m.
, удельная теплоемкость с=С/m.