ТЕРМОДИНАМИКА БИОЛОГИЧЕСКИХ СИСТЕМ.
1. Особенности термодинамического метода изучения биологических систем. Основные понятия термодинамики.
Термодинамикой называется раздел физики, изучающий обмен энергией между системами. Термодинамика биологических систем – это раздел биофизики, изучающий превращение энергии и ее трансформации в живом организме. Само существование живого организма и все процессы жизнедеятельности в нем тесно связаны с изменением энергетического баланса в системе “живой организм – среда”. Так обмен веществ сопровождается процессами превращения энергии, т.е. обмен энергии и вещества представляет единый процесс, лежащий в основе жизнедеятельности. Человек расходует химическую энергию питательных веществ, превращая этот вид энергии в энергию всех рабочих процессов, и выделяет избыточное количество тепла, поэтому термодинамические методы широко используются при изучении процессов жизнедеятельности живых организмов. В термодинамике вводится понятие системы – это тело или совокупность тел, условно выделенных от окружающего пространства для более удобного рассмотрения процессов, протекающих в ней. Причем микроскопическое строение системы не принимается в расчет. Состояние системы характеризуется параметрами. Такими параметрами состояния могут быть: Т – температура, P – давление, V –объем, m – масса, U – внутренняя энергия, C – концентрация, S – энтропия и т.д. Если параметры системы при взаимодействии ее с окружающими телами не изменяются с течением времени, то состояние системы называется стационарным. По сравнению с живыми организмами, системы, рассматриваемые в технической термодинамике, относительно просты. Они состоят из немногих веществ, реагирующих между собой в соответствии с известными химическими уравнениями, причем условия протекания реакции полностью определяются указанными выше параметрами. Живой организм – это термодинамическая система, состоящая из многочисленных компонентов, свойства и способы взаимодействия которых, вообще говоря, неизвестны. Кроме того, в биологической термодинамической системе начальные значения параметров, не полностью определяют ее состояние. В термодинамике системы разделяются на три вида: 1. Изолированная система – это система, которая не обменивается с окружающей средой ни массой, ни энергией (сосуд Дюара). Изолированная система со временем переходит в состояние термодинамического равновесия. В этом состояние, как и в стационарном, параметры системы сохраняются неизменными. Переход системы из одного равновесного состояния в другое равновесное состояние называется термодинамическим процессом. 2. Закрытая система – это система, которая обменивается с окружающей средой только энергией (любое тело, отдающее теплоту окружающей среде или принимающее ее из среды). 3. Открытая система – это система, которая может обмениваться с другимисистемами и массой,и энергией. С точки зрения термодинамики живые организмы относятся к открытым системам, так как их специфической особенностью является обмен веществ и энергией с окружающей средой. Но рассматривать живой организм только как открытую систему не совсем правомерно, так как он отличается от других открытых систем тремя основными признаками: 1. Живые организмы являются особой формой существования белковыхтел. 2. Они способны к самовоспроизведению. 3. Они способны к саморазвитию. Именно эти биологические особенности развития и функционирования живого организма определяют в конечномитоге замечательную организацию и строгую закономерность сочетания и чередования разнообразных и многочисленные реакций обмена веществ для организма. И не смотряна всю сложность биологических систем, энергетические процессы, происходящие в живых организмах, так как и в неживыхсистемах, подчиняются общим законам термодинамики. На основании этих законов можно: 1. Предусмотреть, возможен ли данных процесс, и вкаком направлениион будет развиваться. 2. Рассчитать энергетические превращения в живом организме, отдельных его системах и органах впокое и при совершении работы. 3. Определить КПД процессов жизнедеятельности и энергии связи биологических соединений. Термодинамика исходит из двух основных законов: I-го и II-го начал термодинамики. 2. Первое начало термодинамики. Изучая физические закономерности, лежащие в основе физиологических процессов живого организма на любом уровне его развития, биологическая термодинамика исходитиз I-го начала термодинамики, которое является выражением закона сохранения энергии. Первое начало термодинамики, обоснованное Ломоносовым, Майером, Гессом, Джоулем, Гельмгольцем является эмпирическим законом, теоретическим обобщением огромного количества экспериментов и наблюдений и поэтому не требует доказательств. Для тепловых процессов первое начало термодинамики формулируется следующим образом. Количество теплоты, переданное системе, идет на изменение внутренней энергии системы и совершение системой работы: Q = ΔU + A. Под внутренней энергией системы понимают сумму кинетической и потенциальной энергий частиц, из которых состоит система. Внутренняя энергия является функцией состояния системы и для данного состояния является вполне определенной величиной. ΔU – есть разность двух значений внутренней энергии, соответствующих конечному и начальному состоянию: ΔU = U2 – U1. Количество теплоты и работа являются функциями процесса, а не состояния. Если система, получая бесконечно малое количество теплоты dQ, претерпевает бесконечно малое изменение внутренней энергии dU, то и совершаемая ею работа будет бесконечно малой – dA. Тогда первое начало термодинамики можно записать в дифференциальном виде: dQ = dU + dA. Величины Q, A, ΔU, dQ, dA, dU могут быть как положительными, так и отрицательными. Условились считать количество теплоты положительным, когда оно подводится к системе и работу – положительной, когда она совершается против внешних сил. Работа и тепло – два способа превращения энергии. Об изменении внутренней энергии системы можно судить по количеству совершенной работы и по количеству выделенного тепла. В живом организме работа не может совершатьсяза счет притока тепла извне, она совершается за счет изменения внутренней энергии при различного рода биохимических процессах, т.е. живой организм неможет работать по принципу тепловой машины. Наиболее общим свойством живой материи является свойство тепловыделения. Тепловыделение свойственно всем метаболизирующим клеткам. В организме при окислении пищевых веществ доконечных продуктов образуется энергия, которая переходит в работу, затрачиваемую на поддержание жизнедеятельности и синтетические процессы. Вся эта работа витоге переходит в тепло, выделяемое организмом. Эта теплота условно называется первичной теплотой. Около 50% энергии, возникающей при окислительных процессах, запасается в макроэнергетических связях (АТФ). При разрыве этих связей освобождается энергия, которая расходуется на выполнение любой работы, которая в конечномитоге также переходит в тепло. Эта теплота, выделяемая при разрыве макроэнергетических связей, запасенных ранеев организме и реализуемых при активной работе, условно называется вторичной теплотой. Из всего сказанного следует, чтообмен веществ в живом организме неразрывно связан с процессами превращения энергии. Следовательно, первый закон термодинамики полностью применим к биологическимсистемам.
3. Второе начало термодинамики.
Первое начало термодинамики позволяет определить количественные соотношения между различными формами энергии, которые принимают участие в данном процессе, но ничегоне говорит о возможности протеканияданного процесса и о направлении, в которомон будет развиваться. Ответна эти вопросы дает второе начало термодинамики, которое справедливо только для изолированных систем и устанавливает закономерности перехода какого-либо вида энергии в работу или в другие виды энергии и показывает направление протекания процессов в природе и этим самым позволяет давать оценку работоспособности различных систем. Существует несколько формулировок второго закона (начала) термодинамики: 1. Теплота сама собой не может переходить от тела с меньшей температурой к телу с большей температурой (Клаузиус). Следствием этого положения является утверждение, что самопроизвольно могут протекать лишь процессы, связанные с переходом энергии от более высокого уровня к более низкому, т.е. по градиенту. 2. Невозможен такой периодический процесс, единственным результатом которого было бы превращение теплоты в работу вследствие охлаждения одного тела (Томсон). Второе начало термодинамики заключаетсяв том, что все процессы превращения протекают с рассеиванием некоторой части энергиив виде тепла. Самые различные виды энергии всегда могут полностью переходить в тепло, но обратное превращение в энергию рабочих процессовне может быть осуществлено полностью. Оно позволяет давать оценку термодинамическим системамне только с точки зрения их общего запаса энергии, но и с точки зрения качества, ценности этой энергии в смысле возможности получить работу. Для характеристики степени "полезности" теплоты, а также для количественной оценки неизбежных потерь при преобразовании теплоты, содержащейся в даннойсистеме,в работу или другие виды энергии, используют величину, которая называется энтропией S. Изменение энтропии равно: Превращение различных видов энергии в теплоту является своеобразным обесцениванием энергии. Но и тепло имеет различную ценность в зависимости от температурных условий, так, например, понижениетемпературы системы при переходе некоторого количества тепла в работу сопровождается обесцениванием остальной, не подвергавшейся превращению теплоты. В связи с этим, Клаузисом и было введено понятие энтропии. Понятие энтропии используется для характеристики обратимых и необратимых, но близких к обратимым (например, изотермических), процессов, приводящих систему к тому же конечному состоянию. Введя понятие энтропии, второе начало термодинамикиможно сформулировать следующим образом: Все реальные процессы изменения состояния в изолированной системе протекают с увеличением энтропии:
В то же время изменение энтропии определяет обратимость илинеобратимость процессов, протекающих в изолированной системе. Для обратимых процессов, т.е. таких процессов, когда переход системы в первоначальное состояние не требует дополнительной энергии извне (при обратимых процессах возвращение системы в исходное состояние происходит без каких-либо изменений в окружающей среде): В живых организмах источником работы является химическая энергия, которая переходит в работу и теплоту. Тепло рассеивается и этот процесс полностью необратим. Все реальные термодинамические процессы, связаны с потерей энергии и являются необратимыми, следовательно, протекают с увеличением энтропии: Для таких процессов обратный переход системы в исходное состояние связан с необходимостью затраты энергии извне. Среда при этом получает тепло и отдает какую-либо энергию более упорядоченного типа. Таким образом, обратимые процессы характеризуются отсутствием перехода энергии в тепло, а необратимые протекают с рассеиванием части энергии в тепло. Строго обратимых процессов в природе нет. Обратимый процесс представляет собой крайний случай, к которому можно приблизиться, но достигнуть которого никогда не удается. Если в качестве меры необратимости процессов протекающих в системе применять энтропию S, являющуюся параметром состояния системы, то, по Больцману, можно на основании вероятностных соображений следующим образом математически сформулировать связь между энтропией S и термодинамической вероятностью системы:
т.е. энтропия, кроме того, что она служитмерой рассеивания энергии, является мерой вероятности состояния системы, т.е.имеетстатистический характер. Термодинамическая вероятность ω представляет собой количество микросостояний, возможных в пределах данного макросостояния. Если математическая вероятность никогдане превышает единицы, то термодинамическая вероятность выражается обычно огромным числом, так как равняется числу всех перегруппировок элементов системы вданном состоянии. Согласно 2 закону термодинамики, самопроизвольные необратимые процессы приводят к увеличению энтропии системы. А увеличение энтропииозначает увеличение термодинамической и, следовательно, математической вероятности состояния системы. Таким образом, самопроизвольные процессы приводят к установлению наиболее вероятного состояния системы, при котором энтропия максимальна. Так, для газа наиболее вероятным состоянием является состояние с наиболее беспорядочным распределением частиц, что соответствует максимуму энтропии. Пример: Идеально изолированная термодинамическая система состоит из двух сосудов А и В, заполненных одним и тем же газом. Концентрация CA > CB при одинаковой температуре во всех точках системы.
Если открыть кран K, то газ из сосуда А начнет перемещаться самопроизвольно в сосуд B, концентрация молекул его станет равномерной по всему объему этих сосудов. Суммарные энергетические ресурсы этой системы двух сосудов осталисьнеизменными.Но вместе с тем, в системе произошли существенные изменения с точки зрения второго начала термодинамики. Начальное состояние системы являлось термодинамически неравновесным. Это состояние не могло самопроизвольно поддерживаться без затраты внешней работы. Вместе стем, оно характеризовалось определенной упорядоченностью в распределении молекул, известной организацией (большая плотность газа в сосуде A и меньшая в – B). Второе состояние, установившееся после выравнивания концентраций, определяется как термодинамическое равновесие. Обратный процесс, при котором газ из состояния равномерного распределения перейдёт в описанное выше состояние (неравновесное) крайне маловероятен, т.е. практически никогда не будет происходить. Система,не смотряна неизменность энергетических запасов, пришла в такое состояние, при котором ее работоспособность оказалась сниженной. Состояние равномерного распределения является наиболее вероятным и поэтому энтропия при нем достигает максимума (Smax). Всякое колебание плотности будет означать уменьшение энтропии. Однако, процессы, связанные с уменьшением энтропии, в высшей степени маловероятны, или, иными словами, исходя из статистической интерпретации второго начала термодинамики, можно утверждать, что степень упорядоченности системы либо остается постоянной, либо уменьшается. Но как раз у биологических объектов мы встречается стемчто, например, в организме питательные вещества, находящиеся на относительно низком энергетическом уровне, превращаются в вещества с более высоким содержанием энергии и более высокой степеней упорядоченности. На первый взгляд кажется, что это противоречит второму началу термодинамики. Но второй закон справедлив только для изолированных систем. Биологические системы постоянно обмениваются веществом и энергией с окружающей средой и к изолированным системам не относятся, поэтому применение второго начала термодинамики к живым системам оспаривалось некоторыми учеными. Однако большинство исследователей приходят к выводу, что рассмотрение жизненных процессов с точки зрения этого принципа является весьма плодотворным.
4. Связь между свободной, связанной энергией и энтропией.
Изменение энтропии в процессе реакции не всегда легко измерить и вычислить. Однако это изменение можно количественно связать с изменением общей энергии системы через 3-ю функцию (свободную энергию) посредством уравнения, объединяющего I и II начала термодинамики. В изотермических условиях (T-const) работа процесса соответствует разности между внутренней энергией системы и той частью внутренней энергии, котораяне может быть превращена в работу и называется связанной энергией: A=U-TS, член А означает совершенную работуи называется свободной энергией (F): F=U-TS, F - свободная энергия Гельмгольца (T-const). Изэтого уравнения следует, что U=F+TSт.е. внутренняя энергия U системы равна сумме свободной энергии U и связанной энергии TS. Свободная энергия – это та часть внутренней энергии системы, котораяможет быть использована для совершения работы. Связанная энергия – та часть внутренней энергии, котораяне используется для совершения работы, а бесполезно рассеивается в виде тепла. Связанная энергия определяется энтропией если процесс идет при T=const. Чем больше энтропия, тем больше количество связанной энергии, а чем больше всистеме связанной энергии,тем интенсивнее рассеивание энергии втепло и тембольше необратимым является процесс. Таким образом, энтропия – это мера рассеивания, деградации энергии, а такжемера необратимости процесса. Максимальная работа приизотермическом обратимом процессе будет равна изменению свободной энергии: Amax = dF. Приобратимом процессесистема производит на каждом его этапе такую же внешнюю работу, которую нужно затратить, чтобы вернуть ее в исходное состояние. При необратимом процессе часть свободной энергии рассеивается в тепло и совершенная работа бывает меньше, чем уменьшение свободной энергии, затраченной на эту работу. Отношение произведенной работы к изменению свободной энергии, израсходованной на эту работу, называется коэффициентом полезного действия (КПД):
Биофизические и биохимические процессы, протекающие в живых организмах, с точки зрения термодинамики являются необратимыми, их КПДменьше единицы, для обратимых процессовон равен единице.
5. Основы теории открытых систем. Отличия стационарного состояния от термодинамического равновесия.
В течение длительного время считали, что второй закон термодинамики неприменим к биологическим системам, т.к. согласно этому закону в системах могут происходить лишь процессы, связанные с рассеиванием энергии, с уменьшением свободной энергии, с уменьшением градиентов. В конечном итоге эти процессы приводят к установлению термодинамического равновесия. В организме, однако, происходят как градиентные процессы (пассивный транспорт веществ), так и противоградиентные процессы (активный транспорт веществ). Работоспособность биологических систем такжене уменьшается со временем, т.е. с точки зрения классической термодинамикижизнь – это невероятное состояние. Все процессы в системе должны приближаться к термодинамическому равновесию, что применительно кживым организмам означает приближение к смерти. Но все это только кажущееся несоответствие, так как организм человека и другие живые организмы являются открытыми системами, а законы термодинамики были разработаны для изолированных систем. В связи сэтим термодинамика живых организмов может быть рассмотренакак термодинамика открытых систем. Теория открытых систем быларазработана Колосовским, Де Донде, И. Пригожиным. Открытаясистема обменивается с окружающей средой и веществом и энергией, поэтому общее изменение свободной энергии dFи энтропии dS в такой системе разделяетсяна две части: dFi и dSi – обусловленные процессами, протекающими внутри системы; dFe и dSe, обусловленные взаимодействием с окружающей средой:
Многие ученые используют понятие отрицательная энтропия, или НЕГЭНТРОПИЯ, считая при этом, что в организме постоянно продуцируется положительная энтропия, аиз окружающей среды в организм постоянно поступает отрицательная энтропия. Следует отметить, что отрицательная энтропия понятие условное, под которым следует понимать не запас упорядоченности, а свободную энергию, поступающую с пищей. Так как все биохимические и биофизические процессы в организме являются необратимыми, то dFi < 0, a dSi > 0. При наличии биосинтеза в организме может наблюдаться местное уменьшение энтропии и увеличение свободной энергии, но это происходит лишь за счет увеличения Sи уменьшения F в другой части организма. Причем подобные процессы носят локальный характер. Таким образом, эта оговорка не изменяет общего правила, согласно которому протекание суммарного процесса в организме сопровождается уменьшением F и увеличением S. Восполнение свободной энергии происходит за счет поступления в организм питательных веществ, а выведение энтропии осуществляется за счет выведения конечных продуктов обмена и теплоты. Энтропия в организме может оставаться постоянной величиной, может увеличиваться и может даже уменьшаться, однако во всех случаям энтропия системы "организм – среда" возрастает, что находится в полном соответствии со вторым законом термодинамики. Уравнение (1) можно записать в следующем виде:
Это уравнение является математическим выражением2-го закона термодинамики для живых организмов, т.е. скорость изменения энтропии в организме равна алгебраической суммескорости производства энтропии внутриорганизма и скорости поступления отрицательной энтропии из среды в организм. Определенные соотношения скоростей химических процессов обуславливают такое состояние живого организма, при котором различные физико-химические показатели и различные градиенты остаютсяна одном уровне. Иначе говоря, живые организмы обладают известной устойчивостью. Поэтому для нас важно такое состояние системы, когда скорость производства энтропии равна скорости поступления отрицательной энтропии из среды в систему т.е. общее изменение энтропии системы равно нулю. Состояние системы, при которой параметры еесо временем не изменяются, но происходит обмен веществом и энергией с окружающей средой, называется стационарным. Уравнение (3) является уравнением стационарного состояния. Сходство термодинамического равновесия и стационарного состояния заключается в том, что параметры, как в том, так и в другом случае, не меняются во времени. Но постоянство параметров при стационарном состоянии достигается не в результате отсутствия всяких направленных процессов, как при термодинамическом равновесии, а в результатетого, чтоскорость и направленность этих процессов постоянны и взаимоуравновешены. По существугомостаз – это стационарное состояние организма. Стационарное состояние присущене только организму вцелом, но и отдельным его клеткам. Вследствие необратимости процессов ворганизме скорость производства энтропии внутринего больше нуля:
Пригожин на основе изучения открытых систем сформулировал основное свойство стационарного состояния: в стационарном состоянии скорость возрастания энтропии, обусловленной протеканием необратимых процессов, имеет положительное и минимальноеиз возможных значений. Это положение получило название теоремы Пригожина, таккак энтропия является мерой рассеивания свободной энергии, но при стационарном состоянии рассеивание свободной энергии бывает минимальным. Система для поддержания стационарного состояния требует минимальногоиз всех возможных значений притока свободной энергии. Организм стремится работать на наиболее выгодном энергетическом уровне. Стремление энтропии к минимальной величине ведет к тому, что при любом отклоненииот стационарного состояния в системе наступают такие внутренние изменения, которые будут стремиться вернуть ее к минимуму производстваэнтропии и приближать систему вновь к стационарному состоянию. Система самонастраивается на наиболее выгодный, устойчивый термодинамический режим функционирования. Это свойство системы называется аутостабилизацией. Например, повышение температурывнешней среды действует на механизмы терморегуляции и приводит к уменьшению организмом теплопродукциии к увеличению теплоотдачи. Стационарное состояние поддерживается в организме на основе обратной связи. Воздействие внешних факторов может изменить уровень стационарного состояния, однако эти изменения должны лежать в пределах физиологических норм, которые обусловлены совершенством ауторегулирующих механизмових возможностями. Если ауторегулирующие механизмы способны поддерживать стационарное состояние биологической системы, при данном изменении внешних условий, то организм адаптируется к этим условиям, в противном случае в организме могут произойти патологические изменения, а возможно и его гибель.
Точное измерение температуры является неотъемлемой частью биологических исследований и медицинской диагностики. Температурный интервал окружающей среды, в которой могут находиться биологические системы, сохраняя свою жизнеспособность, вполне определенный. Диапазон температур самих живых организмов в состоянии их активной деятельности является совсем незначительным. Методы получения и измерения температур в широком диапазоне весьма разнообразны. Раздел прикладной физики, изучающий методы измерения температур тел и связанные с этим вопросы, называется термометрией. Температура не может быть измерена непосредственно. Для ее определения необходимо установить температурную шкалу, т.е. выбрать определенное термометрическое вещество и его свойство, зависящее от температуры, условится о начальной точке отсчета и единице измерения температуры. Для температурной шкалы обычно выбирают две основные температуры (реперные точки), соответствующие фазовым переходам, например, плавлению льда и кипению воды при определенных внешних условиях. Участок шкалы между этими точками называют основным интервалом, за единицу температуры берут его определенную долю. Например, 1˚С составляет 0,01 основного интервала. Можно построить большое количество шкал, различающихся по термодинамическому свойству или веществу, так как ни одно из свойств не зависит от температуры строго линейно и определяется природой вещества. Независимая от свойств и вещества шкала построена на основе второго начала термодинамики и названа термодинамической шкалой температур. За ее реперную точку принята температура тройной точки воды 273,16 К. Тройная точка воды – это температура, при которой тающий лед, вода и насыщенный пар, давление которого при этом составляет 0,006 атм, находятся в равновесии. Единицей термодинамической шкалы является Кельвин (К) - Любая эмпирическая шкала приводится к термодинамической посредством введения поправок, учитывающих зависимость термометрического свойства данного вещества от температуры. Разнообразие методов измерения температуры связано с большим количеством термодинамических веществ и свойств, используемых при этом. Для измерения температуры служат термометры, основанные на различных явлениях, например, теплового расширения тел, изменения их электрического сопротивления, термоэлектрических явлениях и т.д. Необходимое условие измерения температуры – тепловое равновесие чувствительного элемента термометра и тела, температуру которого определяют. В зависимости от измеряемых интервалов температур наиболее распространенными термометрами являются жидкостные, газовые, термометры сопротивления, термопары как термометры и как пирометры (регистрируют интенсивность излучения тела, температуру которого измеряют). В медицинской практике используют ртутные термометры, указывающие максимальную температуру и называемые максимальными. Для измерения количества теплоты, выделяемого или поглощаемого телом в различных биологических, физических, химических процессах, применяется целый ряд методов, совокупность которых называется калориметрией. Методами калориметрии измеряют теплоемкость тел, теплоту фазовых переходов, растворения, смачивания, адсорбции, теплоту, сопровождающую химические реакции, энергию излучения, радиоактивного распада. Эти измерения проводятся с помощью калориметров, которые разделяются на два основных типа: приборы, в которых количество теплоты определяется по изменению их температуры и приборы, у которых T = const, а количество теплоты определяется по количеству вещества перешедшего в другое фазовое состояние. Для калориметров первого типа, которых большинство, количество теплоты, полученное системой калориметр – исследуемое тело, определяется по формуле: Q = cΔT, где c – удельная теплоемкость калориметрической системы; ΔT – изменение ее температуры. Для определения ΔT, измеренного на опыте, должна быть внесена поправка, учитывающая теплообмен с окружающей средой. В этом отношении все калориметры можно разделить на калориметры с изотермической и адиабатической оболочками, содержащие регуляторы температуры. Калориметры могут быть использованы и в качестве термостатов.
7. Гипертермия и гипотермия.
При нарушении теплового баланса между организмом и окружающей средой может наблюдаться гипертермия (от греч. hyper – сверх и terme – тепло) – перегревание организма человека вследствие нарушения соотношения между теплопродукцией и теплоотдачей. При температуре тела 41 – 42˚C может наступить тепловой удар. Искусственную гипертермию используют в медицине для местного нагревания при лечении некоторых заболеваний. При этом для наружного воздействия используются различные нагретые среды. Используемые среды должны обладать определенными физическими свойствами и в течение определенного времени обеспечивать нужный эффект. Основное требование – это большая удельная теплоемкость (вода, грязи) или удельная теплота фазового превращения (парафин, озокерит). Среда, накладываемая на кожу, не должна создавать болезненных ощущений. Это ограничивает температуру таких сред. Например, вода, применяемая для лечения, имеет температуру 45˚C, торф и грязи – до 50˚C. Парафин нагревают до 60 - 70˚C, так как он обладает небольшой теплопроводностью, поверхностная его часть, прилегающая к телу, быстро остывает, отвердевает и задерживает приток температуры от остальной его части. Охлаждение, понижение температуры тела теплотворных животных и человека вследствие теплоотдачи, превосходящей теплопродукцию, называют гипотермией (от греч. hypo – под, внизу). Такое состояние приводит к снижению жизнедеятельности организма, повышает устойчивость его к кислородному голоданию. Как лечебный метод применяют искусственную гипотермию как местную (при кровотечении, травмах воспалении), так и общую (при операциях, требующих временной остановки кровообращения). В качестве охлаждающей среды, используемой для лечения, применяют лед. При низких температурах осуществляют консервацию отдельных органов и тканей в связи с трансплантацией. Криогенный метод (от греч. kryos – холод, мороз, лед) разрушения ткани при замораживании и размораживании используется для удаления миндалин, барадавок и т.п. Для этих целей используются специальные криогенные аппараты и криозонды. С помощью холода, обладающего анестезирующим действием, можно уничтожить в головном мозгу человека клетки ядер, ответственных за некоторые нервные заболевания, например, паркинсонизм. В микрохирургии используется “примерзание” влажных тканей к холодному металлическому инструменту для захвата и переноса этих тканей. ЛЕКЦИЯ №11
|

 .
.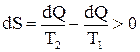 .
. и ΔSОБР = 0.
и ΔSОБР = 0. .
.

 .
. . (1)
. (1) . (2)
. (2)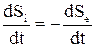 и тогда
и тогда  , (3)
, (3)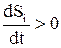 .
. термодинамической температуры тройной точки воды, т.е. Кельвин равен
термодинамической температуры тройной точки воды, т.е. Кельвин равен 


