ОСМОТИЧЕСКИЙ МЕХАНИЗМ
На пути в клетку или органеллу вода, как и другие вещества, должна пройти через плазмалемму, а для поступления в вакУ' оль — еще и через тонопласт. Односторонняя диффузия молекул воды или другого растворителя через полупроницаемую мембрану называется осмосом (от греч. osmos — давление, толчок). Причиной осмоса является разность концентраций растворов по обе стороны полупроницаемой мембраны. В 1748 г. А. Ноллет впервые наблюдал, как растворитель проходит через мембрану из разбавленного раствора в более концентрированный. Система, в которой можно наблюдать осмос, называется осмотической. Она состоит из растворов разных концентраций или из раствора и растворителя, разделенных полупроницаемой мембраной. Пространство, окруженное такой мембраной и заполненное каким-нибудь раствором, получило название осмотической ячейки. Изучение осмоса в растительной клетке началось давно. В 1826 г. французский ботаник Г. Дютроше смастерил для этого очень простое приспособление: к кончику стеклянной трубки он привязывал мешочек из пергамента, заполненный раствором соли или сахара, и опускал его в стакан с водой. При этом вода поступала в мешочек и раствор немного поднимался по трубке. Это была простейшая модель клетки, которую назвали осмометром Дютроше.
В 1877 г. немецкий ботаник В. Пфеффер создал более совершенную модель растительной клетки (рис. 3.3), названную осмометром Пфеффера. Роль клеточной стенки играл пористый фарфоровый сосуд. Полупроницаемую мембрану получили, налив внутрь фарфорового сосуда раствор медного купороса и погрузив этот сосуд в другой, — с раствором ферроцианида калия. В результате в порах фарфорового сосуда, где оба раствора соприкасались, возникла полупроницаемая мембрана из ферроцианида меди — Cu2[Fe(CN)6]. Затем фарфоровый сосуд наполнили раствором саха-
Таким образом, было показано, что клетка представляет собой осмотическую систему. Теперь мы хорошо знаем, что более концентрированный раствор — это клеточный сок, менее концентрированный находится в свободном пространстве клеточной стенки, а роль полупроницаемой мембраны выполняют сообща плазмалемма, то-нопласт и расположенная между ними цитоплазма (см. рис. 3.3). Поскольку в цитоплазме находится очень много разных органелл, окруженных мембранами, то всю ее в данном случае тоже можно считать полупроницаемой. Однако это слишком упрощенное представление о клетке как об осмотической системе. Любая органелла цитоплазмы, окруженная мембраной, представляет собой осмотическую ячейку. В результате осмотическое передвижение воды происходит также между отдельной органеллой и цитозолем. Идеальная полупроницаемая мембрана пропускает молекулы воды и не пропускает молекул растворенного вещества. Сопротивление движению воды зависит от липидного бислоя и от конфигурации (строения и расположения) белковых глобул. Маленькие молекулы воды легко диффундируют через плазмалемму в обоих направлениях: в клетку и из нее. Проницаемость плазмалеммы для воды достаточно велика. Например, если внести тяжелую воду в среду, окружающую корни, то через 1 — 10 мин процент этой воды в клетках корня будет таким же, как во внешнем растворе. Вещества, разрыхляющие плазмалемму (например, пипольфен, вытесняющий кальций из мембран), увеличивают ее проницаемость для воды, а также для ионов. Как долго вода может поступать в вакуоль? Теоретически поступление воды должно прекратиться, когда концентрация растворов по обе стороны полупроницаемой мембраны сравняется. Однако это не так. Соединив свой прибор, имитирующий клетку, с трубкой, В. Пфеффер установил, что в результате поступления воды в фарфоровый сосуд с раствором сахара концентрация раствора уменьшается и движение воды замедляется. Поступление воды в более концентрированный раствор приводит к увеличению объема жидкости, поднятию ее по трубке осмометра. Вода будет подниматься по трубке до тех пор, пока давление водяного столба в ней не станет равным силе, с которой молекулы воды поступают в осмометр. В достигнутом состоянии равновесия полупроницаемая мембрана в единицу времени пропускает в обоих направления* одинаковые количества воды. То дополнительное давление, кото- рое необходимо приложить к раствору, чтобы помешать одностороннему току растворителя (воды) в раствор через полупроницаемую мембрану, назвали осмотическим давлением (я). Давление столба жидкости в трубке служит мерой осмотического давления раствора. В 1877 г. В. Пфеффер измерил осмотическое давление нескольких растворов, приготовленных растворением одного и того же количества вещества в разных объемах растворителя. Датский химик Я. Вант-Гофф обобщил его результаты и предложил уравнение для расчета осмотического давления (л): π = RTc, где R — газовая постоянная; Т— абсолютная температура; с — концентрация раствора в молях. Это уравнение оказалось применимым ко всем разбавленным растворам, кроме растворов электролитов. Электролитическая диссоциация приводит к образованию в растворе большего числа частиц растворенного вещества и этим вызывает увеличение осмотического давления. Поэтому в уравнение (1) был введен показатель /—изотонический коэффициент, равный 1 + а (п — 1), где а — степень электролитической диссоциации, п — число ионов, на которые распадается молекула электролита. В результате уравнение осмотического давления приняло следующий вид: π = RTci. (2) Таким образом, осмотическое давление разбавленного раствора при постоянной температуре определяется количеством молекул, Ионов растворенного вещества в единице объема. На величину осмотического давления влияет концентрация лишь растворенных в воде веществ. Эти вещества называются осмотически активными (осмотиками). К ним относятся органические кислоты, аминокислоты, сахара, соли. Суммарная концентрация этих веществ в клеточном соке варьирует у большинства клеток от 0,2 до 0,8 М. Осмотическое давление измеряют, определяя то внешнее давление, которое следует приложить, чтобы предотвратить подъем воды по трубке осмометра. Оно выражается в атмосферах, барах или пас-калях (1 атм = 1,013 бара = 105 Па; 103Па = 1 кПа; 106 Па = 1 МПа). "астворы с одинаковым осмотическим давлением называются изо-т°ническими (изоосмотическими); между ними осмос не наблюда-ется. Раствор, имеющий большее осмотическое давление, называ-егся гипертоническим, меньшее — гипотоническим.
Такое объяснение поступления воды в клетку в течение многих лет считалось единственно правильным. Однако в 1918 г. А. Урш-прунг и Г. Блюм (Германия) доказали, что поступление воды в клетку зависит не только от разности осмотического давления в разных компартментах клетки. Поступая в клетку, вода тем самым увеличивает объем вакуоли, которая давит на цитоплазму и заставляет протопласт прижиматься к клеточной стенке. Клеточная стенка растягивается, отчего клетка переходит в напряженное состояние — тургор. Давление протопласта на клеточную стенку получило название тургорного. Если бы клеточная стенка могла растягиваться неограниченно, то поступление воды в вакуоль шло бы до тех пор, пока концентрация растворов снаружи и внутри клетки не сравнялась. Но так как клеточная стенка имеет небольшую эластичность, она начинает давить на протопласт в противоположном направлении. Это давление клеточной стенки на протопласт называется тургорным натяжением. Тургорное натяжение в соответствии с третьим законом Ньютона равно по абсолютной величине тургорному давлению, но противоположно ему по знаку. Давление клеточной стенки на протопласт противодействует дальнейшему поступлению воды в клетку. Когда оно станет равным осмотическому давлению, поступление воды в клетку прекратится. Таким образом, осмотическое поступление воды приводит к возникновению гидростатического (тургорного) давления. Разница между осмотическим давлением клеточного сока и противодавлением клеточной стенки определяет поступление воды в клетку в каждый данный момент. В 1959 г. Т. А. Беннет-Кларк показал, что передвижение воды с помощью диффузии из одной системы в другую зависит от разницы в свободной энергии. Согласно молекулярно-кинетической теории, молекулы всех веществ находятся в состоянии быстрого хаотичного движения, скорость которого зависит от энергии этих М°' лекул, характеризуемой величиной их химического потенциала. Химический потенциал воды называется водным потенциалом (ψ). Чем ниже энергия молекул воды, тем ниже водный потенциал. Добавление к воде растворимых веществ уменьшает ее химический потенциал, так как ионы связывают воду. Следовательно, химический потенциал чистой воды наибольший; условно при стандартной температуре и стандартном давлении он принят равным нулю. Поэтому химический потенциал любого раствора — отрицательная величина и с увеличением концентрации растворенных веществ становится все более отрицательным. Согласно второму закону термодинамики, перенос энергии, как I и вещества, происходит самопроизвольно лишь от более высокого уровня химического потенциала к более низкому, т. е. по градиенту. Молекулы воды перемещаются всегда в направлении от более высокого водного потенциала к более низкому. Итак, поступление воды в раствор через полупроницаемую мембрану обусловлено разностью между свободной энергией чистой воды и свободной энергией раствора. В 1960 г. был введен термин «водный потенциал клетки». Водный потенциал клетки (Ψкл) — это разность между свободной энергией воды внутри и вне клетки при той же температуре и атмосферном давлении. Величина водного потенциала клетки определяется степенью ее насыщенности водой: чем больше клетка насыщена водой, тем менее отрицателен ее водный потенциал. Чем выше концентрация растворенных веществ в вакуоли или в другой осмотической ячейке, тем сильнее связывается вода, тем меньше энергии расходуется на движение, тем ниже водный потенциал в этой ячейке, тем больше разность потенциалов и тем быстрее поступает вода. Водный потенциал клетки — это мера энергии, с которой вода устремляется в клетку. Таким образом, водный потенциал клетки показывает, насколько энергия воды в клетке меньше энергии чистой воды, и характеризует способность воды диффундировать, испаряться или погло-Щаться. Ту компоненту водного потенциала клетки, которая определяйся присутствием растворенного вещества, обозначают особым Термином — «осмотический потенциал» (Ψπ). Осмотический потенциал раствора связан прямой зависимостью с концентрацией растворенного вещества. С увеличением этой концентрации осмотический потенциал становится все более отрицательной величиной. В менее концентрированных растворах осмотический потенциал соответственно менее отрицателен.
В отсутствие противодавления клеточной стенки (Ψр) поступление воды в клетку определяется водным потенциалом клетки (Ψкл), в начальный момент времени, равным (сначала) осмотическому потенциалу раствора (Ψπ),заполняющего вакуоль. Если рядом окажутся две клетки с разными Ψкл,то вода через клеточную стенку будет переходить из клетки с более высоким (менее отрицательным) укл в клетку с более низким (более отрицательным) Ψкл. Однако с поступлением воды в вакуоль ее объем увеличивается, вода разбавляет клеточный сок, и клеточная стенка начинает испытывать давление протопласта. С увеличением объема вакуоли протопласт прижимается к клеточной стенке и возникает тургорное давление, а вместе с ним и равное ему по величине противодавление клеточной стенки на протопласт (Ψр), о чем мы уже говорили. Когда Ψр достигает довольно большой величины, дальнейший приток воды в вакуоль прекращается. Устанавливается динамическое равновесие, при котором суммарный поток воды равен нулю, т. е. количество воды в вакуоли не изменяется, хотя молекулы воды и продолжают быстро перемещаться через мембрану в обоих направлениях. При этом положительный потенциал гидростатического (тургорного) давления полностью уравновешивает отрицательный осмотический потенциал и клетка перестает поглощать воду; в таком состоянии ее водный потенциал равен нулю. Это состояние называется состоянием насыщения. В состоянии насыщения клетка уже не сможет поглотить воду ни из какого раствора, не сможет и отнять ее от другой клетки. Итак, водный потенциал клетки зависит от осмотического потенциала (—Ψπ) и от потенциала гидростатического (тургорного) давления (─Ψр) и является алгебраической суммой:─Ψкл = Ψπ─Ψр Поскольку осмотический потенциал равен разности между химическим потенциалом раствора и химическим потенциалом чис- той воды, который равен 0, то он всегда отрицателен. Осмотический потенциал показывает, насколько прибавление растворяемого вещества снижает активность молекул. Водный потенциал клетки (Ψкл) тоже отрицателен, так как присутствие растворенных веществ снижает активность молекул воды; потенциал гидростатического давления (Ψр) наоборот, — положителен. Это соотношение параметров можно записать в виде следующего уравнения: ■ −Ψкл =−Ψπ −Ψр (3) В любой данный момент времени водный потенциал клетки определяется разностью между потенциалом тургорного давления и осмотическим потенциалом. Для клеток деревьев в состав этого уравнения включают еще одно слагаемое — гравитационный потенциал (−Ψg), отражающий влияние на активность воды силы тяжести, заметно сказывающийся только при подъеме воды на большую высоту. Он тоже является отрицательной величиной. Вода всегда поступает в сторону более отрицательного водного потенциала: из той системы, где ее энергия больше, в ту, где ее энергия меньше. Если рядом находятся две клетки, вода будет поступать в ту клетку, у которой отрицательнее водный потенциал. Направление движения воды зависит от градиента водного потенциала. В обычных условиях осмотический потенциал клетки не уравновешен полностью давлением клеточной стенки. Следовательно, клеточная стенка растянута не до конца, и вода может поступать в клетку. Чем больше в клетку поступает воды, тем больше растут тургорное (гидростатическое) давление и противодавление клеточной стенки. Наконец, наступает такой момент, при котором клеточная стенка растягивается до предела, осмотический потенциал целиком уравновешивается противодавлением клеточной стенки, а водный потенциал клетки становится равным нулю (состоянием насыщения) (—Ψπ= — Ψp). После этого клетка уже не сможет поглотить воду ни из какого раствора, не сможет она и отнять ее от другой клетки. Это состояние наблюдается в клетках при достаточной влажности почвы и воздуха. Если влажность почвы достаточна, а испарение не слишком интенсивно, клеточная стенка насыщена водой. В этом случае водный потенциал клеточной стенки выше, чем в вакуоли, и вода поступает в вакуоль. Если подача воды к клетке уменьшается, например при недостатке влаги в почве или при усилении ветра, то вначале возникает водный дефицит в клеточных стенках, водный по-Тенциал которых становится ниже, чем в вакуолях, и вода поступа-ет из них в клеточные стенки. Отток воды из вакуоли снижает тур-
В условиях водного дефицита, например при суховее, в молодых тканях резкое усиление потери воды может произойти в результате испарения воды в клетке, но протопласт, сокращаясь в объеме, не отстает от клеточной стенки, а тащит ее за собой. При этом клеточная стенка волнообразно изгибается и не только не давит на протопласт, а, наоборот, стремится его растянуть. Это состояние назвали циторризом. Таким образом, из всего сказанного можно сделать вывод: поступление воды в клетку за счет осмотических сил подготавливает постепенно условия для прекращения поступления воды. Следовательно, поступление воды в клетку — саморегулируемый процесс. Однако если испарение воды продолжается, то опять возникает градиент водного потенциала. Между вакуолью, цитоплазмой и клеточной стенкой после каждого изменения содержания воды устанавливается равновесие. У не имеющих центральной вакуоли меристематических клеток тоже происходит осмотическое поступление воды, причем избирательно проницаемой мембраной является плазмалемма, а осмотически действующим раствором — цитозоль. Знание величины осмотического потенциала имеет большое светолюбивых растений осмотический потенциал более отрицательный, чем у теневыносливых. Обычно отрицательная величина осмотического потенциала больше у мелких клеток по сравнению с крупными. Однако даже соседние клетки одной ткани могут различаться по его величине. Так, в тканях стебля отрицательный осмотический потенциал возрастает от периферии к центру и от основания к верхушке. В корне отрицательный осмотический потенциал, наоборот, постепенно снижается от основания к верхушке. В проводящих тканях стебля и корня осмотический потенциал колеблется от -0,1 до -0,15 МПа, а листьев — от —1,0 до −1,8 МПа. Величина осмотического потенциала изменяется и в пределах растения: у корней −0,5−1,0, у верхних листьев — до −4,0 МПа. Это обусловливает существование градиента водного потенциала клеток от корней к листьям. У молодых растений осмотический потенциал меньше, чем у старых. У деревьев он отрицательнее, чем у кустарников; у кустарников более отрицателен, чем у трав. В почве, атмосфере водный потенциал обычно отрицателен. Величина осмотического потенциала зависит также от температуры, интенсивности света. Они определяют ее годичные и суточные колебания. Около полудня потеря воды в результате транспи-рации и накопление продуктов фотосинтеза в клетках листьев вызывают уменьшение осмотического потенциала. При хорошем водоснабжении, в частности у водных растений, колебания осмотического потенциала зависят только от скорости фотосинтеза, связанного с изменением освещенности в течение дня. Растение может регулировать величину осмотического и, следовательно, водного потенциала. Превращение сложных нерастворимых веществ в растворимые (крахмала в сахар, белков в аминокислоты) приводит к возрастанию концентрации клеточного сока и понижению водного потенциала. Накопление растворимых солей в вакуоли также вызывает изменение его величины. Несмотря на то, что осмотический потенциал меняется в зависимости от внешних условий, для каждого вида растений изменения его величины происходят в определенных пределах. Величину осмотического потенциала некоторые экологи даже считают одной из характеристик вида. Однако осмос в живой клетке нельзя считать просто односторонней диффузией, не зависящей от обмена веществ; для него необходима энергия. Факторы, стимулирующие дыхание, ускоряют поступление воды в клетку и, наоборот, факторы, ингибирующие его, уменьшают ее поступление. Следовательно, для поступления воды в клетки нужна энергия АТФ.
Осмотические процессы лежат в основе многих процессов, например поступления воды, движения органов растения, движения устьиц.
|


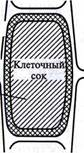
 pa, играющим роль клеточного сока, и поместили в цилиндр с водой. Вода стала поступать в фарфоровый сосуд. То же самое наблюдается и в клетке: если поместить ее в воду, вода поступает в вакуоль.
pa, играющим роль клеточного сока, и поместили в цилиндр с водой. Вода стала поступать в фарфоровый сосуд. То же самое наблюдается и в клетке: если поместить ее в воду, вода поступает в вакуоль. После работ В. Пфеффера поступление воды в клетку стали объяснять только разностью осмотических давлений клеточного сока и наружного раствора: если клетка находится в гипотоническом растворе, или в воде, вода входит в нее {эндосмос); если клетка находится в гипертоническом растворе, то вода выходит из клетки {экзосмос). В последнем случае вакуоль сжимается, объем протопласта уменьшается, и протопласт отделяется от клеточной стенки. Происходит плазмолиз (см. рис. 1.5).
После работ В. Пфеффера поступление воды в клетку стали объяснять только разностью осмотических давлений клеточного сока и наружного раствора: если клетка находится в гипотоническом растворе, или в воде, вода входит в нее {эндосмос); если клетка находится в гипертоническом растворе, то вода выходит из клетки {экзосмос). В последнем случае вакуоль сжимается, объем протопласта уменьшается, и протопласт отделяется от клеточной стенки. Происходит плазмолиз (см. рис. 1.5). В том случае, когда раствор отделен от чистой воды полупроницаемой мембраной, вода поступает в раствор и вследствие этого возникает осмотическое давление, равное по величине, но противоположное по знаку, исходному осмотическому потенциалу. Раствор обладает осмотическим потенциалом, за счет которого возникает такое давление, и его можно обнаружить, если, например, этот раствор поместить в осмометр. Численно по абсолютной величине осмотический потенциал равен тому давлению, т. е. осмотическому давлению, которое необходимо приложить к раствору в осмометре для того, чтобы предотвратить поступление в него воды. Осмотический потенциал есть у раствора всегда, даже если этот раствор в действительности и не развивает осмотического давления.
В том случае, когда раствор отделен от чистой воды полупроницаемой мембраной, вода поступает в раствор и вследствие этого возникает осмотическое давление, равное по величине, но противоположное по знаку, исходному осмотическому потенциалу. Раствор обладает осмотическим потенциалом, за счет которого возникает такое давление, и его можно обнаружить, если, например, этот раствор поместить в осмометр. Численно по абсолютной величине осмотический потенциал равен тому давлению, т. е. осмотическому давлению, которое необходимо приложить к раствору в осмометре для того, чтобы предотвратить поступление в него воды. Осмотический потенциал есть у раствора всегда, даже если этот раствор в действительности и не развивает осмотического давления. горное давление в клетках и, следовательно, уменьшает их водный потенциал. При длительном недостатке воды большинство клеток теряет тургор и растение увядает. В этих условиях протопласт не давит на клеточную стенку; противодавление клеточной стенки равно нулю; водный потенциал клетки равен ее осмотическому потенциалу (−Ψкл = −Ψπ).
горное давление в клетках и, следовательно, уменьшает их водный потенциал. При длительном недостатке воды большинство клеток теряет тургор и растение увядает. В этих условиях протопласт не давит на клеточную стенку; противодавление клеточной стенки равно нулю; водный потенциал клетки равен ее осмотическому потенциалу (−Ψкл = −Ψπ). Почему для осмоса нужна энергия? Во-первых, нужно иметь растворы разной концентрации по обе стороны мембраны; энергия тратится на активный транспорт растворенных веществ в вакуоль и создание градиента концентрации. Во-вторых, осмотически активные вещества, накапливающиеся в вакуоли, являются продуктами метаболизма, следовательно, для их образования тоже затрачивается энергия. И, в-третьих, энергия необходима для сохранения избирательной проницаемости мембран. Стоит прекратить затрату энергии для поддержания структуры мембран, как они станут проницаемыми, что приведет к выравниванию концентраций по обе стороны мембраны — в результате осмос прекратится.
Почему для осмоса нужна энергия? Во-первых, нужно иметь растворы разной концентрации по обе стороны мембраны; энергия тратится на активный транспорт растворенных веществ в вакуоль и создание градиента концентрации. Во-вторых, осмотически активные вещества, накапливающиеся в вакуоли, являются продуктами метаболизма, следовательно, для их образования тоже затрачивается энергия. И, в-третьих, энергия необходима для сохранения избирательной проницаемости мембран. Стоит прекратить затрату энергии для поддержания структуры мембран, как они станут проницаемыми, что приведет к выравниванию концентраций по обе стороны мембраны — в результате осмос прекратится.


