Над раствором.
Давление насыщенного пара растворителя над раствором определяет состояние равновесия между конденсированной и газообразной фазой: Жидкость Û Пар Жидкость находится в равновесии со своим паром тогда, когда число молекул, испаряющихся с её поверхности, равно числу молекул, оседающих на ней из газообразной фазы. Давление над чистым растворителем составляет р0, а мольная доля растворителя N1 равна 1. При внесении нелетучего растворенного вещества часть поверхности раствора занята более или менее сольватированными молекулами этого вещества. Поэтому число молекул растворителя, испаряющихся с поверхности раствора за единицу времени, уменьшается, т.е. N1<1. Это вызывает нарушение равновесия Жидкость Û Пар, и согласно принципа Ле Шателье начинает идти процесс ослабления испарения, т.е. конденсация. Поэтому в растворе N1< 1 давление насыщенного пара растворителя над раствором р1 меньше, чем р0. р1 : р0 = N: 1, отсюда р1 = р0×N1 = р0 ×(1-n) ,(1) где n – число молей растворенного вещества. Изменение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем определяется как: Dр = (р0 – р1) = р0× n, (2) или
где n – число молей растворенного вещества, (моль) N – число молей растворителя, (моль) р0 – давление пара над чистым растворителем, (кПа или Па) Dр–понижение давления насыщенного пара растворителя над раствором (кПа или Па) Уравнение (3) является математическим выражением первого закона идеальных газов Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе или давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженным на мольную долю растворителя:
где р – давление пара над раствором, (кПа или Па) р0 – давление пара над чистым растворителем, (кПа или Па) N – число молей растворителя, (моль) n – число молей растворенного вещества (моль). Пример 1: Вычислить давление пара раствора, содержащего 45 г глюкозы в 720 г воды при 250С. Давление пара воды при 250С составляет 3167 кПа. Решение: По первому закону Рауля 1) Найдем число молей растворителя N = mН2О/МН2О =720/18 =40 моль. 2) Найдем число молей растворенного вещества: N = mглюкозы/ Мглюкозы = 45/180 =0,25 моль. 3) Ответ: Давление пара раствора составляет 3147,3 кПа
2) Осмотическое давление. Одним из явлений, связанных с изменением концентрации свободных молекул растворителя, является осмос. Осмос – диффузия молекул растворителя из растворов через полупроницаемую перегородку, разделяющую раствор и чистый растворитель, или два раствора различной концентрации. Этот процесс двусторонний. Давление, которое надо приложить к раствору, чтобы скорости обоих процессов стали равными называется осмотическим давлением. К осмотическому давлению приложены все газовые законы: 1) Осмотическое давление разбавленного раствора прямопропорционально концентрации раствора и обратнопропорционально его объёму, т.е. приложен закон Бойля – Мариотта. 2) Осмотическое давление раствора прямопропорционально его абсолютной температуре (закон Гей Люссака). 3) При одинаковых концентрациях и температурах растворы с равными осмотическими давлениями называются изотоническими (закон Авагадро) и т.д. Наибольшая аналогия выражена в законе Вант-Гоффа: Осмотическое давление разбавленного раствора численно равно тому давлению, которое производило бы данное количество вещества, занимая в виде газа при данной температуре объём, равный объему раствора. Росм = См×R×Т (5), где росм – осмотическое давление, (кПа или Па) См – молярная концентрация, (моль/л) R – универсальная газовая постоянная, (Дж/моль К) Т – температура (К). или росмV = n×R×Т (6), где росм – осмотическое давление, (кПа или Па) V – объем газа, (л) n – число молей растворенного вещества,(моль) R–универсальная газовая постоянная, (Дж/моль К), Т–температура (К). Пример 2: Вычислить осмотическое давление при 220С раствора, в 1,2 л которого содержится 20,5 г сахара С12Н22О11 (М = 342 г/моль). Решение: По закону Вант-Гоффа: росм RТ 1) Найдем молярную концентрацию раствора: См= mр.в×1000./М р.в. ×V См = 20,5×1000/342 ×1200 = 122,5 кПа 2) росм= 0,05 ×8,314 295 = 122,5 кПа ОТВЕТ: осмотическое давление составляет 122,5 кПа.
|

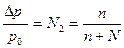 , (3)
, (3) , (4)
, (4)



