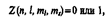Принцип Паули. Распределение электронов в атоме по квантовым состояниям. Периодическая система элементов Менделеева и ее особенности.
Принцип Паули:в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l, m l и ms,т. е.
где Z (n, l, m l, ms)— число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n, l, m l, ms Д. И. Менделеев ввел понятие порядкового номера Z химического элемента, равного числу протонов в ядре и соответственно общему числу электронов в электронной оболочке атома. Расположив химические элементы по мере возрастания порядковых номеров, он получил периодичность в изменении химических свойств элементов. Д. И. Менделееву удалось уточнить атомные веса некоторых элементов. Так как химические и некоторые физические свойства элементов объясняются внешними (валентными) электронами в атомах, то периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах. Поэтому для объяснения таблицы будем считать, что каждый последующий элемент образован из предыдущего прибавлением к ядру одного протона и соответственно прибавлением одного электрона в электронной оболочке атома.
|