Определение коэффициента сверхсжимаемости газа.
Коэф. сверхсжимаемости z реальных газов показывает отношение объемов равного числа молей реального Vp и идеального Vи газов при одинаковых давлении и температуре: z= Vp / Уи. Коэф-т z определяет величину, отношения объемов реального газа при пластовых Vпл и стандартных Vст условиях. При этом он непосредственно зависит от величины пластового давления Рпл, Па и температуры Т, К. Коэф. сжимаемости точно находят экспериментальным путем по пластовым пробам газа. При отсутствии таких исследований (как это чаще всего бывает на практике) прибегают к расчетному методу оценки Z по графику Г. Брауна. Для пользования графиком необходимо знать так называемые приведенные псевдокритическое давление и псевдокритическую температуру. Критической называется такая температура, выше которой газ не может быть превращен в жидкость ни при каком давлении. Критическим давлением называется давление, соответствующее критической точке перехода газа в жидкое состояние.
Коэффициент сверхсжимаемости Z обязательно используется при подсчете запасов газа для правильного определения изменения объема газа при переходе от пластовых условий к поверхностным, при прогнозировании изменения давления в газовой залежи и при решении других задач. 9. Термодинамические функции газа: теплоемкость и энтальпия. Теплоемкостью С называют количество теплоты, необходимое для нагревания единицы массы или объема вещества на 1° С. Удельная теплоемкость - отношение теплоёмкости к единице количества газа. Для газов обычно различают теплоемкости при постоянном объеме Сv и постоянном давлении Сp. Сv связана с процессом, характеризующимся тем, что при неизменности объема вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Сp связана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. Поэтому Сp> Сv. Для идеальных газов между Сp и Сv существует следующее соотношение Сp = Сv+ R, где R — газовая постоянная. В области давлений, где газы считаются идеальными, значения теплоемкостей постоянны. Однако для реальных газов значения теплоемкости изменяются в зависимости от давления и температуры.
где Сi— теплоемкости отдельных компонентов смеси; yi – объемное (молярное) содержание компонентов в долях единицы; n – число компонент Энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Энтальпию часто определяют как полную энергию вещества, так как она равна сумме его внутренней энергии (и) в данном состоянии наряду с его способностью проделать работу (pv). Но в действительности энтальпия не указывает полную энергию вещества при данной температуре выше абсолютного нуля (-273°С). Следовательно, вместо того, чтобы определять энтальпию как полную теплоту вещества, более точно определять ее как общее количество доступной энергии вещества, которое можно преобразовать в теплоту: H = U + pV где U – внутренняя энергия газа.
|

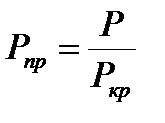 ,
, 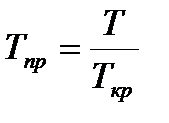 . Для упрощения расчетов можно использовать выражение В.В. Латонова - Г.Р. Гуревича, которое является аппроксимацией графиков Брауна:
. Для упрощения расчетов можно использовать выражение В.В. Латонова - Г.Р. Гуревича, которое является аппроксимацией графиков Брауна: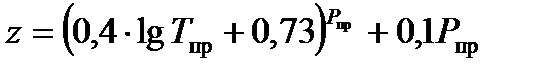
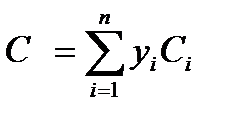 Для смеси газов теплоемкость определяется по сумме теплоемкости входящих компонентов по формуле
Для смеси газов теплоемкость определяется по сумме теплоемкости входящих компонентов по формуле


