Эпоксидирование ненасыщенных соединений
Для эпоксидирования гомологов этилена используют не молекулярный кислород, а пероксидные соединения. Общим методом эпоксидирования олефинов есть реакция Прилежаева, состоящая во взаимодействии олефинов с перкислотами – перуксусной кислотой. Пероксикислота реагирует в циклической форме с внутримолекулярной водородной связью, когда на пероксидном атоме кислорода появляется частичный положительный заряд, обеспечивающий возможность электрофильной атаки двойной связи:
 
Реакция проводится в растворителе при температуре 30-500С, когда дальнейшее присоединение карбоновой кислоты с раскрытием a-оксидного цикла еще не является существенным. Способ эпоксидирования по двойной связи состоит в использовании перуксусной кислоты, синтезируемой непосредственно в реакционной смеси из уксусной кислоты и пероксида водорода при кислотном катализе. Так как a-оксиды чувствительны к действию кислот, поэтому этот способ дает хорошие результаты только при осуществлении в системе, состоящей из двух фаз (водная и органическая), когда перкислота, образующуяся в водной фазе, переходит в органическую и там эпоксидирует нерастворимое в воде ненасыщенное органическое вещество:
СН3-СООН + Н2О2
 СН3-СОООН + RCH=CH2 ® CH3-COOH + RCH-CH2 СН3-СОООН + RCH=CH2 ® CH3-COOH + RCH-CH2
Для эпоксидирования водорастворимых соединений с двойной связью (прежде всего аллилового спирта и акролеина) был разработан другой способ, основанный на применении водного раствора пероксида водорода при катализе вольфрамовой кислотой Н2WO4. Механизм реакции состоит в образовании пероксовольфрамовой кислоты H2WO5, реагирующей с олефинами:
H2WO4 + ¾ С ¾ С¾
Реакция нашла практическое применение в бесхлорном способе получения глицерина, при котором не образуется хлор и нет большого количества отходов и сточных вод. Исходным реагентом служит аллиловый спирт (или акролеин), дающий в водном растворе пероксида водорода глицидоловый спирт, который во второй стадии гидролизуется в глицерин:
СН2=СН-СН2ОН ОН ОН ОН
|



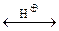 СН3СОООН + Н2О
СН3СОООН + Н2О
 +
+ 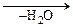 НO-W-O
НO-W-O 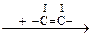 HO-W О
HO-W О О
О СН2 -СН-СН2ОН
СН2 -СН-СН2ОН 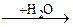 СН2 – СН - СН2
СН2 – СН - СН2


