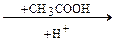Синтез винилацетата из этилена
(метод ацетоокисления) СН2=СН2 + СН3СООН + 0,5О2 ® СН2=СН-ОСОСН3 + Н2О
Синтез осуществляется в присутствии катализатора на основе палладия. Если их взаимодействие протекает не в водном растворе, а в среде уксусной кислоты, то промежуточный карбокатион имеет строение
СН2=СН-ОСОСН3 ® СН3-СН(ОСОСН3)2 Жидкофазный процесс проводят с катализатором PdCl2×CuCl2 в среде уксусной кислоты с добавками ацетата натрия или хлорида лития. Кроме этилидендиацетата побочными продуктами являются н -бутен (за счет димеризации этилена) и ацетальдегид. Так как при получении винилацетата образуется вода, то с накоплением ее в реакционной среде увеличивается выход ацетальдегида. Сохрання определенное соотношение уксусной кислоты и воды, можно осуществить совместный синтез винилацетата и ацетальдегида. Из-за относительно низких выходов и сильной коррозии жидкофазный процесс был замещен газофазным. Газофазный процесс осуществляется с гетерогенным катализатором (Pd на SiO2, Al2O3 или на алюмосиликате с добавкой натрия), в котором роль медных катализаторов выполняет носитель, который способствует окислению палладия в двухвалентную форму:
Pd + 0,5O2 + 2CH3-COOH ® Pd2+ + H2O + 2CH3-COO- Pd2+ + CH2=CH2 + CH3-COOH ® Pd + CH2=CH-OCO-CH3 + 2H-
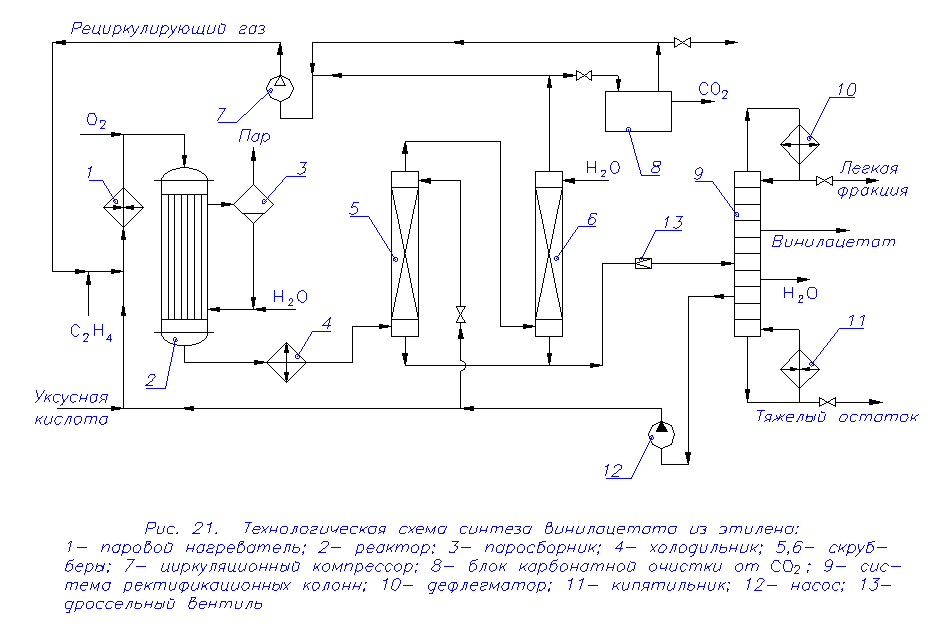
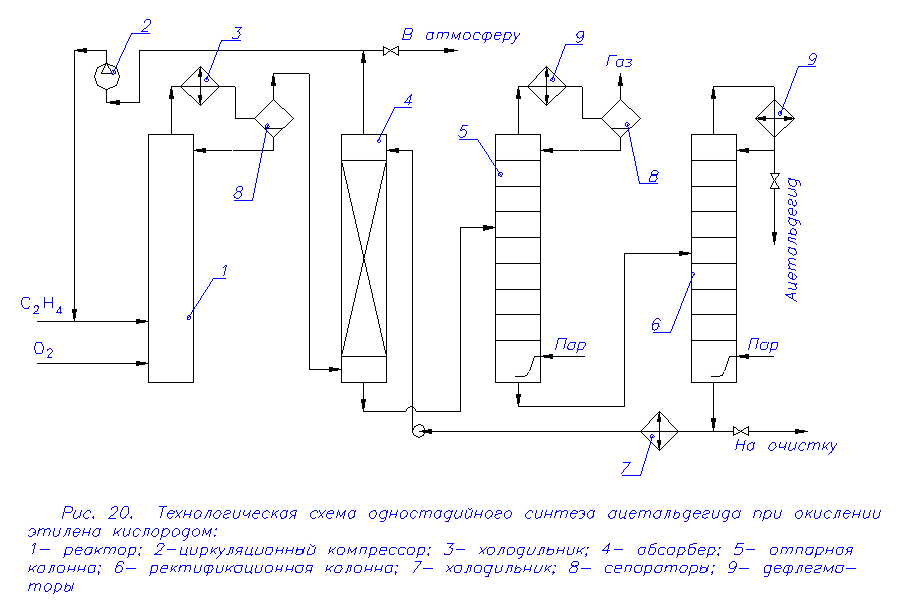
Процесс ведут при температуре 170-1800С и давлении 0,5-1,0 МПа, пропуская паро-газовую смесь через гетерогенный катализатор. Чтобы избежать образования взрывоопасных смесей, применяют избыток этилена и уксусной кислоты. Непревращенный этилен возвращают на окисление, поэтому в качестве окислителя применяют не воздух, а кислород. Исходная смесь состоит из этилена, паров уксусной кислоты и кислорода в соотношении приблизительно равном 8:4:1. Степень конверсии за один проход – 10 %; 20 %; 60 %. Селективность по винилацетату составляет 91-92 %. Основным побочным продуктом является углекислый газ, этилацетат, этилидендиацетат - все не более 1 %. Технологическая схема синтеза винилацетата представлена на рис.21.
литература 1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1988. 2. Одбашен Г.В., Швец В.В. Лабораторный практикум по химии и технологии основного органического и нефтехимического синтеза. – М.: Химия, 1992. 3. Лисицин В.М. Химия и технология промежуточных продуктов. – М.: Химия, 1987. 4. Мугаплинский Ф.Ф. и др. Химия и технология галогенорганических соединений. – М.: Химия, 1991. 5. Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза. – М.: Химия, 1992. 6. Кирпичников П.А., Лиакумович А.Г., Победимский Д.Г., Попова Л.М. Химия и технология мономеров для синтетических каучуков. –Л.: Химия, 1981. 7. Черный И.Р. Производство сырья для нефтехимического синтеза. – М.: Химия, 1983. 8. Галкин В.Ю., Гуревич Г.С. Технология оксосинтеза. – Л.: Химия, 1981. 9. Спарченко В.К. Дегидрирование углеводородов. – Киев: Наукова думка, 1981. Содержание
Характеристика процессов окисления. 3 Определение и классификация реакций окисления. 3 Окислительные агенты и техника безопасности в процессах окисления 5 Окислительные агенты.. 5 Техника безопасности процессов окисления. 6 Энергетическая характеристика реакций окисления. 7 Радикально-цепное окисление. 7 Кинетика и катализ реакции радикально-цепного окисления. 10 Селективность окисления. 12 Реакторы процессов жидкофазного окисления. 13 Окисление углеводородов в гидропероксиды. 15 Синтез фенола и ацетона. 15 Получение гидропероксидов. 16 Окисление парафинов. 20 Окисление низших парафинов в газовой фазе. 20 Окисление н-парафинов в спирты.. 21 Окисление парафинов в карбоновые кислоты.. 21 Окисление парафинов С4 - С8. 22 Окисление твердого парафина в СЖК.. 24 Окисление нафтенов и их производных. 25 Циклоалканы и дикарбоновые кислоты.. 26 Окисление нафтенов в спирты и кетоны.. 26 Получение дикарбоновых кислот. 30 Окисление метилбензолов в ароматические кислоты.. 33 Одностадийное окисление метилбензолов в растворе уксусной кислоты.. 35 Окисление насыщенных альдегидов и кислот. 37 Окисление альдегидов. 37 Синтез уксусной кислоты.. 39 Совместный синтез уксусной кислоты и уксусного ангидрида. 40 Гетерогенно-каталитическое окисление углеводородов и их производных. 42 Теоретические основы процесса. 42 Кинетика и селективность. 44 гетерогенно-каталитического окисления. 44 Реакторы процессов гетерогенно-каталитического окисления. 45 Окисление олефинов по насыщенному атому углерода. 48 Окисление пропилена в акролеин. 48 Получение акриловой кислоты.. 49 Окислительный аммонолиз углеводородов. 49 Синтез синильной кислоты.. 51 Окислительный аммонолиз олефинов. 51 Окислительный аммонолиз метилбензолов. 54 Синтез фталевого и малеинового ангидридов. 54 Производство малеинового ангидрида. 56 Производство этиленоксида. 58 Окисление этилена воздухом.. 60 Окисление этилена кислородом.. 60 Окисление олефинов в присутствии металлокомплексных катализаторов. 63 Эпоксидирование ненасыщенных соединений. 63 Эпоксидирование гидропероксидами. 65 Окисление и окислительное сочетание олефинов при катализе комплексами металлов. 67 Синтез карбонильных соединений. 67 Производство ацетальдегида из этилена. 69 Синтез винилацетата из этилена (метод ацетоокисления). 70 Литература. 75
|

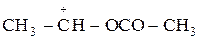 и может не только реагировать со второй молекулой уксусной кислоты, но и отщеплять протон, образуя винилацетат:
и может не только реагировать со второй молекулой уксусной кислоты, но и отщеплять протон, образуя винилацетат:
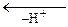 СН3=СН-ОСОСН3
СН3=СН-ОСОСН3