Лабораторная работа № 23.
ФОТОЭЛЕКТРОКОЛОРИМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА(III) В ВИДЕ ТРИСУЛЬФАСАЛИЦИЛАТА ЖЕЛЕЗА(III) Лабораторная работа № 23.
Сущность работы: Железо(III) образует с сульфосалициловой кислотой ряд комплексных соединений в зависимости от кислотности раствора. При рН 9-11,5 образуется комплекс состава 1:3, растворы которого окрашены в желтый цвет: λ; max = 400-430 нм.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ: Реактивы: 1. Железо-аммонийные квасцы, ч.д.а. 2. Сульфосалициловая кислота, 20%-ный раствор 3. Аммоний хлористый, 2 Н. р-р. 4. Кислота соляная, концентрированная. 5. Аммиак водный (10% р-р). Лабораторная посуда: 1. Колбы мерные емкостью 50 мл 2. Пипетки градуированные емкостью 1, 2, 5 и 10 мл Приборы: 1. Фотоэлектроколориметр 2. Весы аналитические
Методика работы 1. Приготовление стандартного раствора железа(III) с концентрацией 0,1 мг/мл Навеску железоаммонийных квасцов, необходимую для приготовления стандартного раствора, вычисляют по формуле:
где m – навеска NH4Fe(SO4)2 • 12H2O, г; T – титр железа(III) в стандартном растворе, мг/мл; V– общий объем стандартного раствора железа(III), мл; M – мольная масса железа, равная 55,85 г/моль; M´– мольная масса NH4Fe(SO4)2 • 12H2O, равная 482,21 г/моль. Взятую на аналитических весах навеску, точно равную вычисленной, количественно переносят в мерную колбу емкостью 100 мл, добавляют небольшое количество дистиллированной воды и 1 мл концентрированной серной кислоты и растворяют соль при нагревании. После охлаждения раствор доводят водой до метки и тщательно перемешивают. 2. Приготовление рабочего стандартного раствора железа(III) с концентрацией 0,005 мг/мл Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 20 раз. Для этого отбирают 5 мл стандартного раствора железа(III) с концентрацией 0,1 мг/мл и доводят дистиллированной водой до метки в колбе на 100 мл. 1 мл полученного раствора содержит 0,005 мг железа.
|

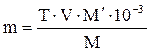 , г
, г


