В нейтральной молекуле сумма степеней окисления всех элементов равна нулю, а в ионе - заряду иона.
Степени окисления элементов. Как найти степени окисления?
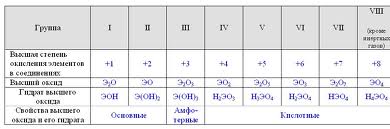
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na0, H02, P04. 2) Необходимо запомнить элементы, для которых характерны неизменные степени окисления. Все они перечислены в таблице.
3) Поиск степеней окисления остальных элементов основан на простом правиле: В нейтральной молекуле сумма степеней окисления всех элементов равна нулю, а в ионе - заряду иона.
Рассмотрим применение этого правила на простых примерах. Пример 1. Необходимо найти степени окисления элементов в аммиаке (NH3). Решение. Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х - искомая степень окисления. Составляем простейшее уравнение: х + 3*(+1) = 0. Решение очевидно: х = -3. Ответ: N-3H3+1.
Пример 2. Укажите степени окисления всех атомов в молекуле H2SO4. Решение. Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2*(+1) + х + 4*(-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H+12S+6O-24.
Пример 3. Рассчитайте степени окисления всех элементов в молекуле Al(NO3)3. Решение. Алгоритм остается неизменным. В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1*(+3) + 3х + 9*(-2) = 0. Ответ: Al+3(N+5O-23)3.
Пример 4. Определите степени окисления всех атомов в ионе (AsO4)3-. Решение. В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4*(-2) = -3. Ответ: As(+5), O(-2).
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение! Пример 5. Определите степени окисления всех элементов в (NH4)2SO4. Решение. Степени окисления водорода и кислорода известны, серы и азота - нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH4+ и SO42-. Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N-3H4+1)2S+6O4-2. Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Пример 6. Укажите степени окисления всех элементов в CH3CH2OH. Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3. Атом С в составе группы -СН2ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1. Ответ: С-3H+13C-1H+12O-2H+1.
Подобрала и отредактировала материал: Лукьянченко А.А. Использованы материалы с сайтов: http://www.repetitor2000.narod.ru/st_okisl.html http://www.himhelp.ru/section23/section3/section18/ Картинки: http://www.google.ru/ Материал размещен в группе: http://vk.com/xum_bio
|