Решение. Запишем два уравнения реакций дикарбоновых кислот с гидроксидом бария в общем виде:
Запишем два уравнения реакций дикарбоновых кислот с гидроксидом бария в общем виде:
Здесь М1 = а – молярная масса первой дикарбоновой кислоты и М2 = а + 14 – молярная масса высшего гомолога (+СН2) этой кислоты. М = а + 137 – 2 и М = а + 14 + 137 – 2. Количество вещества низшего гомолога дикарбоновой кислоты обозначено х моль. Такие же количества вещества
Рассчитаем количество вещества гидроксида бария в объеме V = 333 мл (1/3 л) раствора с концентрацией cмол = 0,09 моль/л:
Расход основания Ва(ОН)2 в реакциях (1) и (2) равен: х + у = 0,03 моль. Откуда х = 0,03 – у. В реакции (1) масса полученной соли: m1 = В реакции (2) масса образующейся соли: m2 = у•(а + 149). х•(а + 135) + у•(а + 149) = 7,31. Подставляя х = 0,03 – у, решим это уравнение относительно у: (0,03 – у)•(а + 135) + у•(а + 149) = 7,31, у = (3,26 – 0,03а)/14. Дальнейшее решение осуществляем подбором вариантов значений молярной массы М = а возможных дикарбоновых кислот:
Если М = а = 90, то у = (3,26 – 0,03•90)/14 = 0,56/14 = 0,04 моль, что не соответствует условию задачи, где х + у = 0,03 моль. Если М = а = 104, то у = (3,26 – 0,03•104)/14 = 0,01 моль. Следующий гомолог: М = а = 118 г/моль не подходит, т.к. тогда количество вещества у = (3,26 – 0,03•118)/14 = –0,02 моль – отрицательная величина. Ответ. В состав смеси входили кислоты НООССН2СООН (0,02 моль) и НООССН2СН2СООН
|

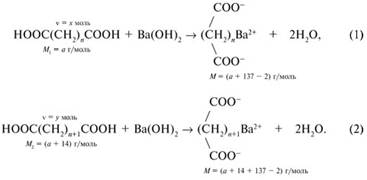
 = х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2):
= х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2):


