L-глутаминовая кислота (глутамат)
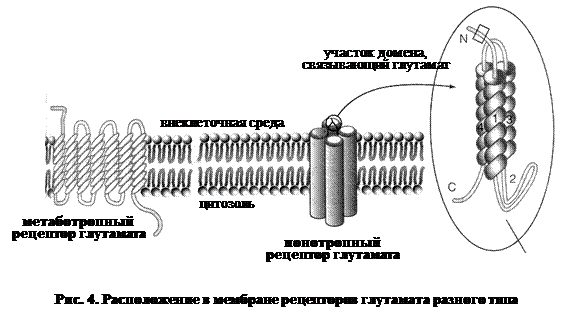
L-глутаминовая кислота (глутамат ) – главный возбуждающий нейромедиатор в мозге млекопитающих, а также предшественник других аминокислот, в частности ГАМК. Обнаруживается во всех отделах ЦНС. Глутамат обеспечивает передачу возбудительных сигналов по длинноаксонным волокнам. В ЦНС находится около миллиона длинноаксонных нейронов, и в большинстве из них передача нервных импульсов происходит посредством глутаминовой кислоты. Так, афферентные сенсорные волокна, передающие зрительные, слуховые, тактильные, болевые сигналы, содержат в качестве медиатора глутамат. Это же относится и к большинству ассоциативных волокон, связывающих различные структуры мозга. Глутамат вовлечен в процессы восприятия и обработки стимулов, благодаря тому, что он обеспечивает быструю синаптическую передачу (в миллисекундном интервале времени). Высвобождение глутамата из пресинаптического окончания происходит путем Са-зависимого экзоцитоза, а удаление из синаптической щели путем обратного захвата пресинаптическим окончанием. Рецепторы к глутамату подразделяются на следующие функциональные группы (рис. 4):
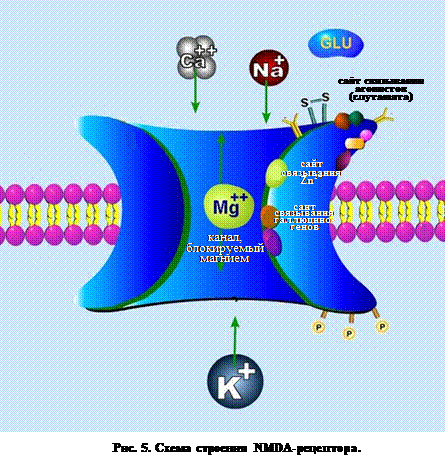
Ø ионотропные – лиганд-управляемые: ü NMDA-рецепторы широко распространены в ЦНС,располагаются пресинаптически и постсинаптически. Высокая их плотность обнаружена в кортикальных структурах, базальных ганглиях, сенсорно-ассоциативных системах, в гиппокампе. NMDA-рецепторы образуют неспецифические ионные каналы, обеспечивающие прохождение ионов К+, Na+ и Са2+. В отличие от He-NMDA-рецепторов, вызывающих быструю деполяризацию, активация NMDA-рецепторов приводит к пролонгированной деполяризации мембраны. NMDA-рецепторов являются потенциал-зависимыми кальциевыми каналами, канал которых в состоянии покоя блокируются ионами Mg2+ (рис. 5). Для их разблокирования необходима деполяризация мембраны, а также глицин в качестве сомедиатора глутамата. В отсутствие глицина рецептор не активируется глутаматом. Это представляет определенный интерес с фармакологической точки зрения, так как антагонисты глициновых рецепторов могут быть использованы в качестве ингибиторов медиации глутамата. Еще одна важная особенность NMDA-рецепторов с точки зрения регуляции – их чувствительность к концентрации водородных ионов: частота открывания ионных каналов снижается по мере возрастания концентрации ионов водорода, таким образом, при рН 6,0 активация рецептора оказывается почти полностью подавленной.
ü не-NMDA-рецепторы распространены по всему мозгу. Они подразделяются на подтипы: · АМРА-рецепторы (активируются аналогом глутамата) при возбуждении которых открываются каналы для ионов Na+ и Са2+, что способствует быстрой деполяризации мембран. · каинат-рецепторы (активируются каиновой кислотой), локализованы преимущественно на терминалях нейронов, высвобождающих глутамат, и при их возбуждении увеличивается его выход в синаптическую щель При активации пресинаптических не-NMDA-рецепторов ионы Са2+ входят в пресинапс, увеличивается их концентрация в терминали, что обеспечивает высвобождение медиатора в синаптическую щель.
Ø метаботропные – mGluR, осуществляющий свой биологический эффект через вторичные мессенджеры IP3 (инозитолтрифосфат) и DAG (диацилглицерол). Метаботропные рецепторы играют роль в механизмах памяти, боли, тревоги, в нейродегенеративных процессах.
Одновременная стимуляция метаботропного mGluR и ионотропного АМРА рецептора делает возможным развития такого процесса как долговременная депрессия синаптической передачи (Long-Term depression – LTD). Механизм формирования LTD следующий (рис. 6): ♦ выделение пресинаптическим полюсом глутамата приводит к одновременной активации АМРА и mGluR рецепторов на постсинаптической мембране; ♦ рецептор mGluR активирует фосфолипазу С, которая в свою очередь расщипляет PIP2 (фосфатидилинозитол-3-4,5-дифосфат) на DAG и IP3; ♦ IP3 вызывает высвобождение Са2+ из ЭПР, кроме того, Са2+ поступает через электровозбудимые каналы мембраны клетки, что приводит к дополнительному усиления выброса кальция из ЭПР; ♦
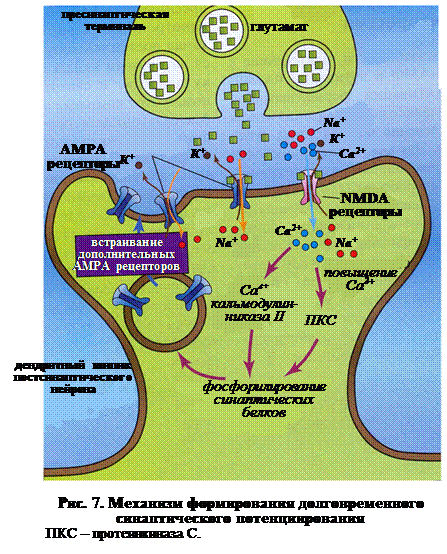
Одновременная стимуляция ионотропных NMDA и АМРА рецепторов делает возможным развитие другого процесса, характеризующего степень активности синапса – долговременной синаптической потенциации (Long-Term potentiation – LTP). Механизм формирования LTP следующий (рис. 7): ♦ выделение пресинаптическим полюсом глутамата приводит к одновременной активации ионотропных АМРА и NMDA рецепторов на постсинаптической мембране; ♦ через катионный канал АМРА в постсинапстическую область входят ионы Na+. деполяризующие синаптическую мембрану; ♦ в результате деполяризации постсинаптической мембраны открывается потенциалзависимый NMDA рецептор (пора рецептора освобождается от иона Mg2+, блокировавшего его в состоянии покоя) и через него в постсинаптический полюс входят Na+ и Са2+; ♦ вход Са2+ в клетку активирует протеинкиназу С; ♦ параллельно Са2+ связывается в комплекс с кальмодулином и активирует Са2+/кальмодулин-киназу II; ♦ в результате фосфорилируются синаптические белки и в мембрану встраиваются дополнительные АМРА рецепторы, что способствует проявлению долговременной синаптической потенциации (Long-Term potentiation – LTP).
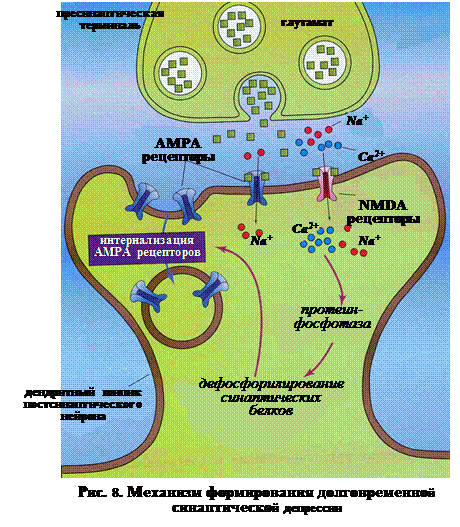
Кроме того, при одновременной стимуляции ионотропных NMDA и АМРА рецепторов возможно развитие долговременной синаптической депрессии (Long-Term depression – LTD). В данном случае будет наблюдаться процесс, противоположный описанному выше. Т.е. результатов некоторых реакций в глутаматергическом синапсе будет не встраивание новых АМРА рецепторов, а их интернализация (поглощение в клетку). Данные процесс реализуется следующим образом (рис. 8): ♦ выделение пресинаптическим полюсом глутамата приводит к одновременной активации ионотропных АМРА и NMDA рецепторов на постсинаптической мембране; ♦ низкоамплитудный подъем концентрации Са2+ приводит к активации протеинфосфотазы, находящейся в постсинаптической зоне; ♦ в результате происходит дефосфорилирование синаптических белков, благодаря чему проявляется интернализация АМРА рецепторов из постсинаптической мембраны; ♦ тем самым, уменьшается возможность связывания глутамата с освободившимися АМРА рецепторами. Благодаря этому возникает долговременная депрессия синаптической передачи (DTP).
Нарушение глутаматергической медиации лежит в основе ряда патологических состояний нервной системы, в частности эпилепсии. Имеются экспериментальные доказательства, что процессы инициации и сохранения эпилептических приступов связаны с высвобождением глутамата при ослаблении ГАМК-ергической передачи. Beщества, блокирующие NMDA-рецепторы, используются в экспериментах в качестве антиконвульсантов. Глутамат обнаружен в большинстве сенсорных волокон, передающих болевые стимулы. В качестве сомедиатора глутамата в этих волокнах представлен нейропептид – вещество Р. Он вызывает дополнительную деполяризацию мембраны, что способствует разблокированию потенциал-зависимых Са2+-каналов и поэтому вносит существенный вклад в передачу болевых стимулов. АМРА-рецепторы активируются в ответ на интенсивные и короткие стимулы и обеспечивают быструю передачу болевых сигналов, NMDA-рецепторы – на последовательно повторяющиеся импульсы. Активация этого типа рецепторов в задних рогах спинного мозга приводит к расширению и пролонгированию нейрональных ответов при постоянстве стимула, что в итоге приводит к усилению болевых ощущений при длительных болях. NMDA-рецепторы вовлекаются в передачу болевых сигналов при таких патологических состояниях, как воспаление, ишемические, невропатологические, хирургические боли. Блокатор этих рецепторов – кетамин – используется в клинике для анестезии. Глутаматные NMDA-рецепторы участвуют в процессах памяти. Экспериментально показано, что ключевую роль в механизме памяти играет длительная потенциация (LTP) пирамидных нейронов поля CA1 гиппокампа. Длительная потенциация – это устойчивое усиление эффективности синапсов в нейронах гиппокампа в ответ на высокочастотную стимуляцию. В возникновении LTP существенную роль играют высвобождение глутамата и активация постсинаптических NMDА-рецепторов на апикальных дендритах пирамидных нейронов. В результате активируются потенциал-зависимые Са2+-каналы и происходит длительная деполяризация мембраны. Важную переключающую функцию в формировании длительной потенциации пирамидных нейронов гиппокампа выполняют ГАМК-ергические механизмы, обеспечивая синхронизацию глутаматергических входов. Помимо гиппокампа LTP обнаружена в коре, миндалине и спинном мозге. Глутамат играет важную роль в развитии мозга и пластичности его связей. Эксперименты показали, что повышенное содержание глутамата в мозге молодых животных стимулировало рост дендритов пирамидных клеток гиппокампа, способствовало развитию нейронов мозжечка. Плотность NMDА-рецепторов в хвостатом ядре и гиппокампе молодых крыс была существенно выше, чем у взрослых особей. В незрелом гиппокампе возбуждающие постсинаптические потенциалы (ВПСП), образующиеся при активации NMDA-рецепторов, существенно оказались выше по амплитуде и менее чувствительны к ионам Mg2+. Результаты этих экспериментов позволяют предположить, что глутамат регулирует рост и дифференциацию нейронов развивающегося мозга. В то же время высокое содержание возбуждающих аминокислот (глутамата и аспартата) токсично для нервной ткани. Высвобождение большого количества этих нейромедиаторов в синаптическую щель приводит к гиперактивации глутаматных рецепторов, в результате которой увеличивается концентрация Са2+ в клетках, повышается осмотическое давление, что ведет к набуханию и гибели нейронов. Кроме того, рост содержания Са2+ в клетках сопровождается активацией киназ и фосфолипаз, в результате увеличивается протеолитическая и липолитическая активность. Эти процессы, получившие название реакции «эксайтотоксичности» (exitotoxicity), - начальная ступень в гибели нейрональных и глиальных клеток при острых сосудистых нарушениях мозга и, возможно, при нейродегенеративных заболеваниях (болезнь Альцгеймера, паркинсонизм, хорея Гентингтона).
|

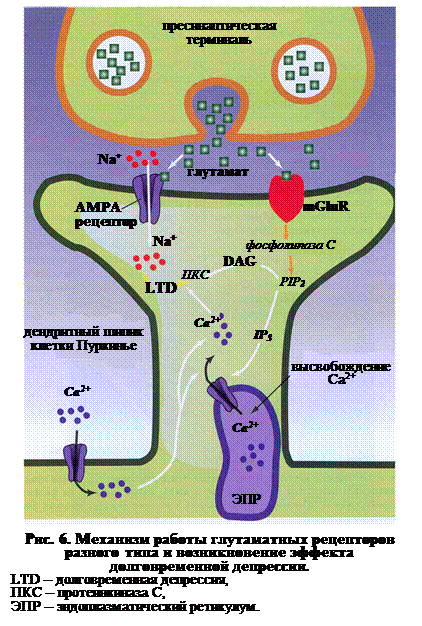 повышение уровня Са2+ и появление DAG совместно активируют протеинкиназу С (ПКС), которая меняет свойства АМРА рецепторов, что приводит к возникновению долговременной депрессии синаптической передачи (DTP).
повышение уровня Са2+ и появление DAG совместно активируют протеинкиназу С (ПКС), которая меняет свойства АМРА рецепторов, что приводит к возникновению долговременной депрессии синаптической передачи (DTP).