Характеристики скла
2.5.1 Склоподібний стан Речовини в твердому стані при звичайних температурі і тиску можуть мати кристалічну або аморфну будову. У природі найпоширенішими є кристалічні тверді речовини, для структури яких характерний геометрично строгий порядок розташування частинок (атомів, іонів) в тривимірному просторі. Кристалічний стан є стабільним при звичайних умовах і характеризується найменшою внутрішньою енергією. Тверді кристалічні речовини мають чіткі геометричні форми, певні температури плавлення, у більшості випадків проявляють анізотропію властивостей. Склоподібний стан речовини є аморфним різновидом твердого стану. Склоподібний стан є метастабільним, тобто характеризується надлишком внутрішньої енергії. Просторове розташування частинок речовини, що знаходиться в склоподібному стані, є неврегульованим, що підтверджується результатами рентгеноструктурних досліджень. Скло може бути отримане шляхом охолодження розплавів без кристалізації шляхом переохолодження розплавів зі швидкістю, достатньою для запобігання кристалізації. Неорганічні розплави, що здатні утворити склофази, переходять до склоподібного стану при температурах нижчих за температуру склування Tg (при температурах вищих за Tg аморфні речовини перебувають у розплавленому стані). Скло може бути отримане також шляхом аморфізації кристалічних речовин, наприклад бомбардуванням пучком іонів, або при осадженні парів на охолоджувані підкладки. 2.5.2 Фізико-механічні властивості скла
2.5.3 Електро-фізичні властивості Залежно від складу і від температури навколишнього середовища скло можуть бути ізолятором (діелектриком), напівпровідником і провідником струму. 2.5.3.1 Електропровідність Велика група оксидних видів скла (силікатні, боратні, фосфатні та ін.) належить до класу ізоляторів, що обумовлено високими значеннями ширини забороненої зони. При кімнатній температурі питома об'ємна електропровідність силікатного скла лежить в межах 10-7...10-15 Ом-1 м-1. Встановлено, що носіями струму в оксидних видах скла є катіони лужних або лужноземельних металів. Низька електропровідність оксидного скла обумовлена малою рухливістю катіонів. Підвищення температури супроводжується зниженням в'язкості, збільшенням рухливості носіїв струму, в результаті чого електропровідність зростає на декілька порядків. Кварцове скло є майже ідеальним ізолятором серед силікатних видів скла. Його електропровідність при кімнатній температурі становить 10-18 Ом-1·м-1, а при 800 °C 10-4 Ом-1·м-1. В результаті адсорбції вологи, а також продуктів хімічної взаємодії поверхні з вологою повітря на поверхні виробів створюється електропровідний шар. У багатьох випадках цей процес є небажаним, оскільки негативно позначається на ізоляційних властивостях скла. Підвищення вмісту в склі оксидів лужних металів прискорює реакцію гідролізу поверхневого шару скла. Введення у склад скла оксидів BaO, MgO, ZnO, PbO до 10...15 % замість SiO2 або спеціальна обробка поверхні парою кремнійорганічних сполук сприяє зниженню поверхневої провідності. 2.5.3.2 Діелектричні властивості скла Силікатні види скла при температурах нижчих за температуру склування (Tg) відносяться до класу діелектриків. Діелектрична проникність скла залежить від його складу, змінюючись для силікатного скла від 3,8 (для кварцового) до 16,2 (для скла з високим вмістом оксидів важких металів) і мало залежить від температури аж до 400...500 °С. З підвищенням частоти поля діелектрична проникність зменшується. Найінтенсивніше цей ефект спостерігається в області низьких частот від 0 до 103 Гц, в той час як в інтервалі 103...1010 Гц це зменшення (при нормальній температурі) не перевищує 10%. З підвищенням температури діелектричні втрати інтенсивно збільшуються і, як наслідок, діелектрик розігрівається. 2.5.3.3 Електрична міцність Електрична міцність скла при тепловому пробої зменшується зі збільшенням товщини зразка внаслідок погіршення відводу тепла від внутрішніх шарів виробу. У змінному електричному полі розігрівання діелектрика здійснюється інтенсивніше (додаються діелектричні втрати), в результаті чого електрична міцність скла в змінному полі нижча, ніж у постійному. Тепловий механізм пробою характерний як для діелектриків, що мають при звичайних умовах досить високе значення електропровідності. Електрична міцність скла при тепловому пробої становить 104...105 кВ·м-1. 2.5.4 Гігієнічні характеристики Скло не виділяє шкідливих речовин, не має запаху, забезпечує тривале зберігання продуктів, добре миється та дезінфікується, легко утилізується, має добрі декоративні можливості. Крім того скляна промисловість забезпечена найбагатшими сировинними ресурсами. Природні властивості скла та його аморфність наділяють цей матеріал крихкістю, але в той же самий час відсутність кристалічної ґратки надає унікальну можливість використати скло в медицині. Скло надзвичайно стійке до різноманітних реагентів (за винятком плавикової кислоти), а також до дій атмосферних явищ. Дуже високі санітарно-гігієнічні властивості скла дають можливість використовувати його не тільки для приготування їжі, але й для довготермінового зберігання продуктів — соління, маринади, компоти, варення, джеми, прянощі тощо. Закорковані у скляних пляшках вина зберігаються багато років, навіть століття, не втрачаючи своїх властивостей. Парфуми ж виготовляють виключно у скляному посуді, бо скло нейтральне хімічно й енергетично, що дає можливість зберегти повний букет ароматів, закладений виробником, а нам — скористатися вишуканим парфумом без будь-яких сторонніх домішок. До речі, знайдені археологами пахощі в скляних пляшечках також зберегли свої властивості, не зважаючи на тисячоліття проведені здебільшого під землею. Скляний посуд використовується багаторазово, адже він добре миється, його можна мити як рідкими, так і абразивними мийними засобами, обробляти парою, кип'ятити (дотримуючись обережності) для повного винищення бактерій і будь-яких небажаних запахів. 2.6 Загальна технологія виготовлення скла За минулі тисячоліття методи виготовлення скла майже не змінилися, найраніші зразки практично нічим не відрізняються від сучасного, усім відомого скла для виготовлення пляшок (винятком є тільки сучасне скло із заданими властивостями). У природному стані воно існує як мінерал обсидіан — вулканічне скло. Величезна кількість модифікацій скла дає змогу найрізноманітнішого утилітарного використання, обумовленого його складом і хіміко-фізичними властивостями. Звичайне віконне скло і скляний посуд являють собою сплав оксиду натрію, оксиду кальцію і діоксиду силіцію. Його приблизний склад можна виразити формулою: Na2O • CaO • 6SiO2. Вихідними матеріалами для виготовлення скла слугує білий кварцовий пісок SiO2, сода Na2CO3 і вапняк або крейда CaCO3. Суміш цих речовин у відповідних співвідношеннях сплавляють у спеціальних печах. Спочатку при 700—800°С внаслідок взаємодії карбонатів натрію і кальцію з діоксидом силіцію утворюються силікати натрію і кальцію:
При 1200—1300 °C силікати натрію і кальцію з надлишком діоксиду силіцію утворюють сплав
Скляну масу в розплавленому стані витримують до повного видалення газів. Разом з тим проводять знебарвлення скла додаванням незначних кількостей діоксиду марганцю MnO2. Звичайне скло буває забарвлене в зелений колір домішками оксидів заліза які потрапляють разом з піском. Діоксид марганцю надає склу рожевого забарвлення, а зелений і рожевий кольори в сукупності дають білий колір. Після цього скляну масу охолоджують до певного ступеня в'язкості і виготовляють різні вироби.
|

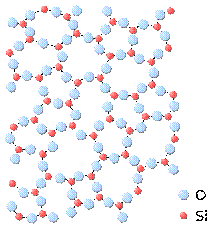 Аморфна структура скла SiO2
Аморфна структура скла SiO2


