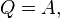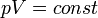Ізотермічний процес
Ізотермічний процес (від др.-греч. ἴσος "Рівний" і θέρμη "Жар") - термодинамічний процес, який відбувається в фізичній системі при постійній температурі.
Кілька ізотерм для ідеального газу нa pV діаграмі Для здійснення ізотермічного процесу систему зазвичай поміщають в термостат (масивне тіло, що знаходиться в тепловій рівновазі), теплопровідність якого велика, так що теплообмін з системою відбувається досить швидко в порівнянні зі швидкістю протікання процесу, і, температура системи в будь-який момент практично не відрізняється від температури термостата. Можна здійснити ізотермічний процес інакше - із застосуванням джерел або стоків тепла, контролюючи постійність температури за допомогою термометрів. До ізотермічним процесів відносяться, наприклад, кипіння рідини або плавлення твердого тіла при постійному тиску. Графіком ізотермічного процесу є ізотерма. В ідеальному газі при ізотермічному процесі добуток тиску на об'єм постійно (закон Бойля-Маріотта). Ізотерми ідеального газу в координатах При ізотермічному процесі системі, взагалі кажучи, повідомляється певна кількість теплоти (або вона віддає теплоту) і вчиняється зовнішня робота. Альтернативний процес, при якому теплообмін з навколишнім середовищем відсутній (термодинамічна система знаходиться в енергетичному рівновазі - система не поглинає і не виділяє тепло), називається адіабатичним процесом. Робота, здійснена ідеальним газом в ізотермічному процесі, дорівнює У твердому тілі і більшості рідин ізотермічні процеси дуже мало змінюють об'єм тіла, якщо тільки не відбувається фазовий перехід. Перший закон термодинаміки для ізотермічного процесу записується у вигляді:
де мається на увазі, що внутрішня енергія системи в ізотермічному процесі не змінюється. , Зако́н Бо́йля — Маріо́тта — закон ідеальних газів, згідно з яким добуток тиску на об'єм незмінної маси такого газу при сталій температурі є величина стала:
. У певних межах справедливий для розріджених реальних газів, тобто для природних і нафтових вуглеводневих газів за нормальних (чи стандартних) умов. Тоді його записують так: p0 V0 = pV, де індекс нуль означає ці умови. Закон відкрив і опублікував у 1662 році Роберт Бойль. Едм Маріотт опублікував такий же закон в 1676 році на основі незалежних досліджень. На термодинамічній діаграмі p — V ізотермічний процес зображаєтсья кривою, що називаєься ізотермою.
|

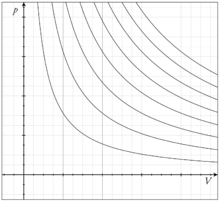
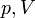 - Гіперболи, розташовані на графіку тим вище, чим вище температура, при якій відбувається процес (див. малюнок).
- Гіперболи, розташовані на графіку тим вище, чим вище температура, при якій відбувається процес (див. малюнок).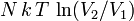 , Де
, Де 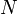 - Число частинок газу,
- Число частинок газу, 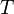 - Температура,
- Температура,  і
і 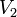 - Обсяг газу на початку і кінці процесу,
- Обсяг газу на початку і кінці процесу, 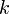 - постійна Больцмана.
- постійна Больцмана.