Третій параметр температура (Т) визначається рівнянням стану.
Ідеальний газ[ред.] Матеріал з Вікіпедії — вільної енциклопедії. Ідеа́льний газ (рос. идеальный газ; англ. ideal gas, нім. ideales Gas n) — це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями до ідеального газу є реальні розріджені гази, тиск в яких не перевищує 200 атмосфер і які перебувають при не дуже низькій температурі, оскільки за таких умов відстань між молекулами набагато перевищує їх розміри. Розрізняють три типи ідеального газу: · Класичний ідеальний газ або газ Максвелла-Больцмана. · Ідеальний квантовий газ Бозе (складається з бозонів). Див. статистика Бозе-Ейнштейна. · Ідеальний квантовий газ Фермі (складається з ферміонів). Див. статистика Фермі-Дірака.
Термодинаміка класичного ідеального газу[ред.] Термодинамічні властивості ідеального газу можна описати такими двома рівняннями: Стан класичного ідеального газу описується рівнянням стану ідеального газу:
Внутрішня енергія ідеального газу описується наступним рівнянням:
де · U — внутрішня енергія (вим. у джоулях) · P — тиск (паскаль) · V — об'єм (метр кубічний) · n — кількість речовини (моль) · R — газова стала (джоуль на моль на градус Кельвіна) · T — абсолютна температура (градуси Кельвіна) · N — кількість молекул · kB — стала Больцмана (джоуль на градус Кельвіна на молекулу)
|


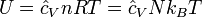
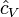 є константою (рівною, наприклад, 3/2 для одноатомного газу) і
є константою (рівною, наприклад, 3/2 для одноатомного газу) і


