Примеры решения типовых задач. Пример 1.Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,32∙10-2
Пример 1. Степень диссоциации уксусной кислоты в 0, 1 М растворе равна 1, 32∙ 10-2. Найдите константу диссоциации кислоты и значение рК. Решение. Подставим данные задачи в уравнение закона разбавления К = a2См/(1 –a) = (1, 32∙ 10-2)2∙ 0, 1/(1–0, 0132) = 1, 77∙ 10-5, откуда рК = – lg (1, 77∙ 10-5) = 4, 75. Расчет по приближенной формуле К = a2См приводит к близкому значению К: К = (1, 32∙ 10-2)2 ∙ 0, 1= 1, 74∙ 10-5, откуда рК=4, 76. Пример 2. Константа диссоциации циановодорода (синильной кислоты) равна 7, 9∙ 10-10. Найдите степень диссоциации HCN в 0, 001 М растворе. Решение. Для расчета воспользуемся приближенной формулой, т.к. константа диссоциации HCN очень мала: a = Пример 3. Вычислите концентрацию ионов водорода в 0, 1 М растворе хлорноватистой кислоты HOCl (К = 5∙ 10-8). Решение. Найдем степень диссоциации HOCl: a =
Контрольные вопросы и задачи для самостоятельной работы 1. Какие соли может образовать фосфорная кислота, если учесть ступенчатость ее диссоциации? 2. Принимая во внимание первую ступень диссоциации H2S, определить a (%) для 0, 01 М раствора его (см. прил. Г). 3. При какой концентрации СН3СООН в водном растворе a = 1%? При какой концентрации a в 2 раза больше, если К=1, 8 × 10-5? 4. Определите концентрацию ионов К+ и ионов SO42- в 0, 1 н растворе сернокислого калия K2SO4, считая диссоциацию этой соли полной. 5. Константа диссоциации одноосновной масляной кислоты С3Н7СООН равна 1, 5∙ 10-5. Какова должна быть степень ее диссоциации в 0, 005 М растворе? 6. Определите степень диссоциации хлорноватистой кислоты НС1О в 0, 2 н растворе, если ее константа диссоциации равна 4∙ 10-8. 7. Степень диссоциации муравьиной кислоты НСООН в 0, 2 н растворе равна 3, 2%. Определите константу диссоциации муравьиной кислоты. 8. Степень диссоциации угольной кислоты по первой ступени в 0, 1 н растворе равна 0, 173%. Рассчитайте константу диссоциации для этой ступени: Н2СО3 «Н+ + НСО3-. 9. При какой концентрации раствора степень диссоциации азотистой кислоты HNO2 будет равна 20%, если константа диссоциации этой кислоты равна К =5∙ 10-4? 10. В 0, 1 н растворе степень диссоциации уксусной кислоты равна 1, 32%, а степень диссоциации соляной кислоты равна 92%. При какой концентрации раствора степень диссоциации уксусной кислоты тоже достигнет 92%? 11. Сколько воды надо прибавить к 300 миллилитрам 0, 2 М раствора уксусной кислоты (К = 1, 8 ∙ 10-5), чтобы степень диссоциации кислоты удвоилась? 12. Какова концентрация ионов водорода в водном растворе муравьиной кислоты (К = 2 ∙ 10-4), если степень диссоциации кислоты в этом растворе равна 5%? 13. Вычислите концентрацию ионов водорода в 0, 02 М растворе сернистой кислоты, учитывая только первую ступень диссоциации, для которой константа диссоциации равна К = 1, 7 ∙ 10-2. 14. Во сколько раз уменьшится концентрация ионов водорода, если к одному литру 0, 2 М раствора уксусной кислоты прибавить 0, 1 моль уксуснокислого натрия, у которого степень диссоциации при таком разбавлении составляет 80%? Константу диссоциации уксусной кислоты примите равной К = 1, 8 ∙ 10-5.
|

 =
= 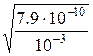 = 8, 9 ∙ 10-4.
= 8, 9 ∙ 10-4. = 7∙ 10-4. Отсюда: [H+] = a∙ СМ =7∙ 10-4∙ 0, 1= 7∙ 10-5.
= 7∙ 10-4. Отсюда: [H+] = a∙ СМ =7∙ 10-4∙ 0, 1= 7∙ 10-5.


