СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называется концентрацией. Рассмотрим несколько способов выражения концентрации. Массовая доля вещества, или процентная концентрация (w%, С%) показывает, какое количество единиц массы растворенного вещества содержится в 100 единицах массы раствора. С% = w% = Молярная концентрация, или молярность раствора (См), – это число молей растворенного вещества, содержащегося в 1л раствора. СМ = где М – молярная масса растворенного вещества (г/моль). Растворы различной молярности принято называть: 1М – одномолярный; 0, 1М – децимолярный; 0, 01М – сантимолярный; 0, 001М – миллимолярный. Эквивалентная концентрация, или нормальность раствора (Сн), – это число эквивалентов растворенного вещества, содержащееся в 1л раствора. СН = Э = где М – мольная масса вещества, n – количество катионов (анионов), В – валент – ность. Валентность – это способность атомов элемента присоединять определенное число атомов другого элемента. Например: Э Н2SO4 = Нормальность раствора обозначают: 1н – однонормальный ратвор; 0, 1н – децинормальный раствор и т.д. Моляльность (Смл) – числo моль растворенного вещества, содержащееся в 1000г растворителя. Смл = где mр-ля – масса растворителя, m1 – масса растворенного вещества, М – мольная масса растворенного вещества.
|


 =
= 
 =
= 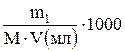 (моль/л), (10)
(моль/л), (10)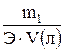 =
=  (моль/л), (11)где Э – эквивалентная масса растворенного вещества (г/моль), которую рассчитывают по формуле:
(моль/л), (11)где Э – эквивалентная масса растворенного вещества (г/моль), которую рассчитывают по формуле: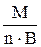 (г/моль), (12)
(г/моль), (12)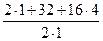 = 49 г/моль; Э Fe(OH)3 =
= 49 г/моль; Э Fe(OH)3 =  = 35, 6 г/моль; Э Al2(SO4)3 =
= 35, 6 г/моль; Э Al2(SO4)3 = 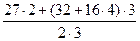 = 114 г/моль.
= 114 г/моль.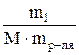 × 1000 (моль/кг), (13)
× 1000 (моль/кг), (13)


